题目内容
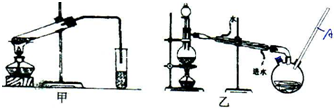
12.某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了下列实验:(1)用如图1所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水和铁反应).
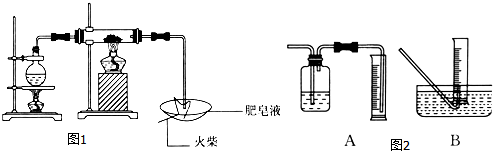
①反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当肥皂泡破裂,有爆鸣声时(填实验现象),说明“铁与水蒸气”能够进行反应.
②写出铁与水蒸气反应的化学方程式3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
③实验中石棉绒的作用是增大铁粉与水蒸气的接触面积.
(2)为了研究一定时间内铁粉的转化率,他们设计了如图2所示实验:准确称量一定质量的铁粉进行反应,收集并测量反应后生成气体的体积,计算出铁粉的转化率.
①收集并测量气体体积应选图中的B装置.
②称取0.24 g铁粉与适量石棉绒混合,然后加热至无气体放出.若室温下氢气密度约为0.088 g/L,最好选用B(选填字母序号)规格的量筒.
A.100 mLB.200 mLC.500 mLD.1 000 mL.
分析 (1)根据铁与水蒸气在高温下反应生成四氧化三铁和氢气,爆鸣声说明有氢气生成,即可说明“铁与水蒸气”能够进行反应,实验中石棉绒可以增大反应物的接触面积,加快反应速率;
(2)①A收集装置错误,不可以测量生成氢气的体积;
②根据铁的质量求出生成氢气的质量,根据氢气的密度求出体积,以此选择量筒的规格.
解答 解:(1)铁与水蒸气在高温下反应生成四氧化三铁和氢气,3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2; 如果肥皂泡破裂,产生爆鸣声说明有氢气生成,即可说明“铁与水蒸气”能够进行反应,实验中石棉绒的作用是增大铁粉与水蒸气的接触面积,加快反应速率;
故答案为:①肥皂泡破裂,有爆鸣声;②3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;③增大铁粉与水蒸气的接触面积;
(2)①排水法收集气体,量气装置的导气管应短进长出,否则不能将水排到量筒中,无法测量气体的体积,
故答案为:B;
②3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2
3×56g 8g
0.24g m(H2)
m(H2)=$\frac{0.24g×8g}{3×56g}$=0.0114g
V(H2)=$\frac{0.0114g}{0.088g/L}$=0.13L
选择量筒时,应尽量减少误差,所取量筒规格与量取体积接近,故应选择规格为200ml的量筒,
故答案为:B.
点评 本题通过实验探究铁与水蒸气的反应,明确铁及其化合物的性质是解题关键,注意排水法测量气体体积的原理及装置特点,注意量筒规格选择.

| A. | Fe2(SO4)3═2Fe3++3SO42- | B. | KClO3═K++Cl-+O32- | ||
| C. | KAl(SO4)2═K++Al3++2SO42- | D. | NaHSO4═Na++H++SO42- |
| 化学反应 | 平衡常数 | 温度(℃) | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O (g) | K3 | ||
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”或“=”).

(3)判断反应③△H<0;△S<0(填“>”“=”或“<”)
在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、CH3OH、H2O的物质的量分别为6mol、2mol、10mol、10mol,此时v(正)>v(逆) (填“>”“=”或“<”)
(4)一定温度下,在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.
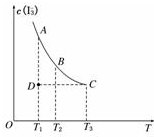 实验室将I2溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)?I3-(aq),上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),下列说法不正确的是( )
实验室将I2溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)?I3-(aq),上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),下列说法不正确的是( )| A. | 该反应的正反应是吸热反应 | B. | A点与C点的化学反应速率vA<vC | ||
| C. | 在反应进行到D点时,v正>v逆 | D. | A点与B点相比,B点的c(I2)大 |
| A. | Ba(OH)2+Na2SO4═BaSO4↓+2NaOH | B. | BaCl2+Na2SO4═BaSO4↓+2NaCl | ||
| C. | BaCO3+H2SO4═BaSO4↓+CO2↑+H2O | D. | BaCl2+H2SO4═BaSO4↓+2HCl |
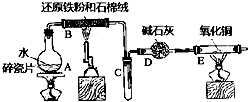 某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)
某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去) 在537℃、1.01×105Pa时,往容积可变的密闭容器中充入1mol X和3mol Y,此时容积为V L.保持恒温恒压,发生反应X(g)+3Y(g)?2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5.
在537℃、1.01×105Pa时,往容积可变的密闭容器中充入1mol X和3mol Y,此时容积为V L.保持恒温恒压,发生反应X(g)+3Y(g)?2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5.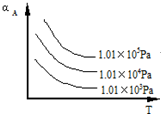 (1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol•L-1,请回答下列问题:
(1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol•L-1,请回答下列问题: