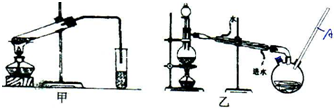
题目内容
15.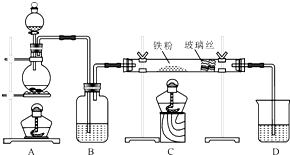 工业上,向500℃~600℃的铁屑中通入氯气生产无水氯化铁(已知炽热铁屑与氯化氢生成氯化亚铁).现用如图所示的装置模拟上述过程进行试验.
工业上,向500℃~600℃的铁屑中通入氯气生产无水氯化铁(已知炽热铁屑与氯化氢生成氯化亚铁).现用如图所示的装置模拟上述过程进行试验.回答下列问题:
(1)盛装浓盐酸的仪器名称为分液漏斗,进行实验时,应先点燃A(选填A或C)处酒精灯.
(2)制取无水氯化铁的实验中,A中反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,装置B中加入的试剂是浓硫酸.
(3)制取的无水氯化铁中混有少量氯化亚铁,其原因是Fe+2HCl=FeCl2+H2(化学方程式表示).为除去氯气中混有的少量HCl,可以在装置A、B间加入装有饱和食盐水的洗气瓶.
(4)工业上常用石灰乳吸收制氯气的尾气制得漂白粉,漂白粉的有效成分是Ca(ClO)2(填化学式).长期露置于空气中的漂白粉,加稀盐酸后产生的气体是③(填数字代号).
①O2 ②Cl2 ③CO2 ④HClO.
分析 实验室制备无水氯化铁:A装置:烧瓶中反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,制取的氯气中含有水蒸气,B装置:容器中装有浓硫酸,浓硫酸有吸水性,且不和氯气反应,用浓硫酸干燥氯气;C装置:氯气与铁在加热条件下生成氯化铁,反应方程式为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3,氯气有毒不能排放到空气中,D装置:吸收尾气氯气,Cl2+2NaOH═NaCl+NaClO+H2O,防止污染空气.实验室利用二氧化锰与浓盐酸加热反应制取氯气,浓硫酸可以干燥氯气,以此解答该题.
解答 解:(1)浓盐酸盛装在圆底烧瓶中,加热时,应先点燃A出酒精灯,以便排出空气,故答案为:分液漏斗; A;
(2)加热条件下浓盐酸和二氧化锰发生氧化还原反应生成氯气,反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,B为浓硫酸,起到干燥氯气的作用,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O; 浓硫酸;
(3)盐酸挥发生成的氯化氢可与铁反应生成氯化亚铁,方程式为Fe+2HCl=FeCl2+H2,应用饱和食盐水除去,故答案为:Fe+2HCl=FeCl2+H2;饱和食盐水;
(4)漂白粉的有效成分是Ca(ClO)2,长期露置于空气中的漂白粉,易变质生成碳酸钙,加稀盐酸后产生的气体是二氧化碳,故答案为:Ca(ClO)2; ③.
点评 本题以氯化铁以及氯化亚铁的制取为载体,考查的是实验室中氯气的制取方法、常见尾气的处理方法,为高频考点,明确氯气制备原理和性质是解题关键,题目难度中等.

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案| A. | 已知温度T时水的离子积常数为Kw,该温度下,将浓度为a mol•L-1的一元酸HA与b mol•L-1的一元碱BOH等体积混合,混合溶液中当c(H+)=$\sqrt{{k}_{W}}$ mol•L-1时可判定该溶液呈中性 | |
| B. | pH=5的H2SO4溶液,加水稀释到500倍,则稀释后c(H+)与c(SO42-)的比为2:1 | |
| C. | 某温度下,水的离子积常数Kw=10-12,该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为9:1 | |
| D. | 将pH=1的盐酸平均分成两份,一份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液,pH都升高了1,则加入的水与NaOH溶液的体积比为11:1 |
| A. | 称量时,左盘低,右盘高 | B. | 定容时俯视读取刻度 | ||
| C. | 原容量瓶洗净后未干燥 | D. | 定容时液面超过了刻度线 |
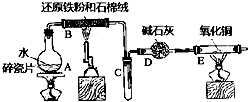 某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)
某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)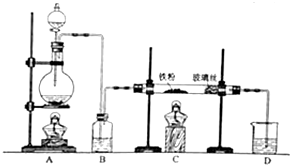 回答下列问题:
回答下列问题: 在537℃、1.01×105Pa时,往容积可变的密闭容器中充入1mol X和3mol Y,此时容积为V L.保持恒温恒压,发生反应X(g)+3Y(g)?2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5.
在537℃、1.01×105Pa时,往容积可变的密闭容器中充入1mol X和3mol Y,此时容积为V L.保持恒温恒压,发生反应X(g)+3Y(g)?2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5.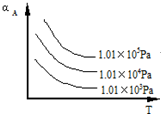 (1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol•L-1,请回答下列问题:
(1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol•L-1,请回答下列问题: