题目内容
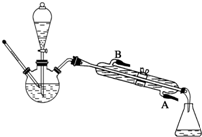
8.化学实验装置的科学设计是实验是否取得预期效果的关键.请回答下列有关实验装置的相关问题:(1)图A为“人教版”教材制备乙酸乙酯的实验装置,某同学甲认为下图B装置进行酯化反应效果比A要好,他的理由是便于冷凝回流,减少反应物损失;
某同学乙经查阅资料认为下图C装置进行酯化反应效果更好,他的理由是既能冷凝回流又能及时分离出反应生成的水,有利于酯的生成.

(2)某有机物的结构简式如图:
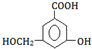
①当其和Na反应时,可转化为
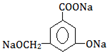 .
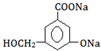
.②当其和NaOH溶液或Na2CO3溶液反应时,可转化为
 .
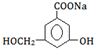
.③当和NaHCO3溶液反应时,可转化为
 .
.
分析 (1)B装置进行酯化反应效果比A要好,B中冷凝管的冷凝效果比长导管的冷凝效果好;C装置进行酯化反应效果更好,因C中分水器可分离出水,冷凝管可冷凝回流反应物;
(2)① →
→ ,酚-OH、-COOH、-OH均反应;
,酚-OH、-COOH、-OH均反应;
② →
→ ,只有酚-OH、-COOH反应;
,只有酚-OH、-COOH反应;
③ →
→ 中,只有-COOH反应.
中,只有-COOH反应.
解答 解:(1)B装置进行酯化反应效果比A要好,理由是便于冷凝回流,减少反应物损失;C装置进行酯化反应效果更好,理由是既能冷凝回流又能及时分离出反应生成的水,有利于酯的生成,
故答案为:便于冷凝回流,减少反应物损失;既能冷凝回流又能及时分离出反应生成的水,有利于酯的生成;
(2)① →
→ ,酚-OH、-COOH、-OH均反应,则应与Na反应,故答案为:Na;
,酚-OH、-COOH、-OH均反应,则应与Na反应,故答案为:Na;
② →
→ ,只有酚-OH、-COOH反应,则与NaOH溶液或Na2CO3溶液反应,故答案为:NaOH溶液或Na2CO3溶液;
,只有酚-OH、-COOH反应,则与NaOH溶液或Na2CO3溶液反应,故答案为:NaOH溶液或Na2CO3溶液;
③ →
→ 中,只有-COOH反应,则与NaHCO3溶液反应,故答案为:NaHCO3溶液.
中,只有-COOH反应,则与NaHCO3溶液反应,故答案为:NaHCO3溶液.
点评 本题考查有机物的制备实验及有机物的结构与性质,为高频考点,把握实验装置的作用、实验技能、有机物的结构与性质为解答的关键,侧重分析与应用能力的考查,注意平衡移动原理及官能团与性质的关系,题目难度不大.

练习册系列答案
相关题目
1.下列反应条件的控制中不恰当的是( )
| A. | 为防止铁生锈,在其表面涂一层防锈油漆 | |
| B. | 为防止火灾,在面粉厂、加油站等场所要严禁烟火 | |
| C. | 为加快KClO3的分解速率,加入MnO2 | |
| D. | 为提高H2O2的分解率,向溶液中滴加FeCl3溶液 |
13.在一定温度下,发生反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g).已知该反应在不同温度下的平衡常数如下表:
请回答下列问题:
(1)该反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,△H<0(填“<”、“>”或“=”)
(2)欲提高上述反应中CO的平衡转化率,可采取的措施是B.
A.提高反应温度 B.移出部分CO2
C.加入合适的催化剂 D.减小容器的容积
(3)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=0.006 mol•L-1•min-1,CO的平衡转化率为60%.
(4)1000℃时,在(2)的平衡体系中,各加0.5molCO和0.5molCO2,v正>v逆(填“<”、“>”或“=”),平衡向正向移动(填“正向”、“逆向”或“不移动”).
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
(1)该反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,△H<0(填“<”、“>”或“=”)
(2)欲提高上述反应中CO的平衡转化率,可采取的措施是B.
A.提高反应温度 B.移出部分CO2
C.加入合适的催化剂 D.减小容器的容积
(3)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=0.006 mol•L-1•min-1,CO的平衡转化率为60%.
(4)1000℃时,在(2)的平衡体系中,各加0.5molCO和0.5molCO2,v正>v逆(填“<”、“>”或“=”),平衡向正向移动(填“正向”、“逆向”或“不移动”).
17.甲醇是重要的化学工业基础原料和液体燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”或“=”).

(3)判断反应③△H<0;△S<0(填“>”“=”或“<”)
在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、CH3OH、H2O的物质的量分别为6mol、2mol、10mol、10mol,此时v(正)>v(逆) (填“>”“=”或“<”)
(4)一定温度下,在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.
| 化学反应 | 平衡常数 | 温度(℃) | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O (g) | K3 | ||
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”或“=”).

(3)判断反应③△H<0;△S<0(填“>”“=”或“<”)
在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、CH3OH、H2O的物质的量分别为6mol、2mol、10mol、10mol,此时v(正)>v(逆) (填“>”“=”或“<”)
(4)一定温度下,在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.
 已知乙酸和乙醇在浓硫酸催化下会发生下列反应:
已知乙酸和乙醇在浓硫酸催化下会发生下列反应: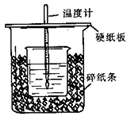 用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: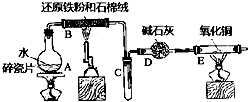 某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)
某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)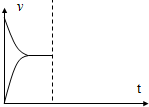 在537℃、1.01×105Pa时,往容积可变的密闭容器中充入1mol X和3mol Y,此时容积为V L.保持恒温恒压,发生反应X(g)+3Y(g)?2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5.
在537℃、1.01×105Pa时,往容积可变的密闭容器中充入1mol X和3mol Y,此时容积为V L.保持恒温恒压,发生反应X(g)+3Y(g)?2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5.