题目内容
一定条件下CuS与稀HNO3发生反应,所得还原产物为NO,氧化产物为SO
.现将0.06molCuS加入到50mL4.2mol/LHNO3中,充分反应之后,忽略溶液体积变化,下列说法正确的是( )
2- 4 |
| A、被还原的硝酸为0.08mol |
| B、反应后溶液中仍有硝酸剩余 |
| C、反应后溶液的pH=1 |
| D、CuS未全部参加反应 |
考点:氧化还原反应的计算,氧化还原反应
专题:氧化还原反应专题
分析:由信息可知,N元素的化合价由+5价降低为+2价,S元素的化合价由-2价升高为+6价,则S失去电子为0.06mol×8=0.48mol,n(HNO3)=0.05L×4.2mol/L=0.21mol,由原子守恒可知,生成CuSO4为0.06mol,若恰好完全反应,作氧化剂的硝酸为
=0.16mol<0.21mol,则硝酸剩余,以此来解答.
| 0.48mol |
| (5-2) |
解答:
解:A.S失去电子为0.06mol×8=0.48mol,由电子守恒可知,被还原的硝酸为
=0.16mol,故A错误;
B.n(HNO3)=0.05L×4.2mol/L=0.21mol,作氧化剂的硝酸为
=0.16mol<0.21mol,则硝酸剩余,故B正确;
C.反应后硝酸剩余为0.21mol-0.16mol=0.05mol,c(H+)=
=1mol/L,pH=0,故C错误;
D.硝酸剩余,则CuS全部参加反应生成硫酸铜,故D错误;
故选B.
| 0.48mol |
| (5-2) |
B.n(HNO3)=0.05L×4.2mol/L=0.21mol,作氧化剂的硝酸为
| 0.48mol |
| (5-2) |
C.反应后硝酸剩余为0.21mol-0.16mol=0.05mol,c(H+)=
| 0.05mol |
| 0.05L |
D.硝酸剩余,则CuS全部参加反应生成硫酸铜,故D错误;
故选B.
点评:本题考查氧化还原反应的计算,题目难度中等,注意根据氧化还原反应的电子守恒和质量守恒计算该题.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
下列说法正确的是( )
| A、水晶、红宝石、珍珠、钻石等装饰品的主要成分都是硅酸盐 |
| B、石油裂解、煤的气化、海水制镁等过程中都包含化学变化 |
| C、有新单质生成的化学反应,一定属于氧化还原反应 |
| D、二氧化硫有漂白、杀菌性能,可在食品加工中大量使用 |
下列液体可以用来保存金属钠的是( )
| A、水 |
| B、浓NaOH溶液 |
| C、煤油 |
| D、CCl4(d>1g/cm3) |
下列各组物质中,属于同系物的是( )
| A、CH3Cl CH3CH2Cl |
B、 |
| C、CH3COOH、CH3CH2OH |
| D、HCHO、CH3COOH |
下列不属于取代反应的是( )
A、CH4+Cl2
| |||
B、CH3Cl+Cl2
| |||
C、CH4+2O2
| |||
D、CH2=CH2+H2
|
下列说法正确的是( )
| A、AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 |
| B、配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 |
| C、Na2CO3溶液不可保存在带磨口塞的玻璃瓶中 |
| D、泡沫灭火器中常使用的原料是碳酸钠和硫酸铝 |
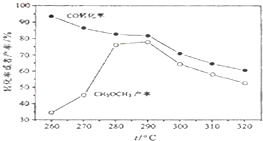 (除零班外其它班做) 一碳化学是国际研究的热点,有研究者在催化剂和压强为5.0MPa的条件下由H2和CO直接制备二甲醚,其反应为:2CO(g)+4H2(g)═CH3-O-CH3(g)+H2O(g),有关图象如图:
(除零班外其它班做) 一碳化学是国际研究的热点,有研究者在催化剂和压强为5.0MPa的条件下由H2和CO直接制备二甲醚,其反应为:2CO(g)+4H2(g)═CH3-O-CH3(g)+H2O(g),有关图象如图: