题目内容
9.下列各反应达到平衡后,减小压强或升高温度都能使化学平衡向正反应方向移动的是( )| A. | N2(g)+3H2(g)?2NH3(g) (正反应为放热反应) | |
| B. | C(s)+CO2(g)?2CO(g) (正反应为吸热反应) | |
| C. | 2NO2(g)?N2O4(g) (正反应为放热反应) | |
| D. | 3O2(g)?2O3(g) (正反应为吸热反应) |
分析 减小压强或升高温度都能使化学平衡向正反应方向移动,则反应为气体体积增大的反应、且吸热的反应,以此来解答.
解答 解:A.合成氨的反应中气体的物质的量减小,为放热反应,则减小压强或升高温度都能使化学平衡向逆反应方向移动,故A不选;
B.为气体体积增大的反应、且吸热的反应,则减小压强或升高温度都能使化学平衡向正反应方向移动,故B选;
C.为气体体积减小、放热的反应,则减小压强平衡逆向移动,升高温度能使化学平衡向逆反应方向移动,故C不选;
D.为气体体积减小、吸热的反应,则减小压强平衡逆向移动,升高温度能使化学平衡向正反应方向移动,故D不选;
故选B.
点评 本题考查化学平衡的影响因素,为高频考点,把握反应的特点、温度和压强对平衡的影响为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
20.下列说法不正确是( )
| A. | 已烷有5种同分异构体,它们的熔点、沸点各不相同 | |
| B. | 在一定条件下,苯与液溴、硝酸作用生成溴苯,硝基苯都属于取代反应 | |
| C. | 油脂皂化反应得到高级脂肪酸盐与甘油 | |
| D. | 电石与水反应,将气体直接通入酸性高锰酸钾溶液,检验气体是否为乙炔 |
4.某实验小组用50mL 1.0mol/L的盐酸与50mL 1.1mol/L的NaOH溶液在如图1所示装置进行中和热的测定,请回答下列问题:
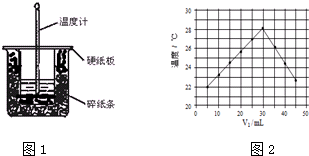
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌器
(2)做1次完整的中和热测定实验,温度计需使用3次,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么?不同意,因为不同温度计误差不同
(3)该实验小组做了三次实验,每次取溶液各50mL,并记录如图原始数据.
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混和液的比热容 C=4.18J(g•℃)则该反应的中和热为
△H=-56.8kJ/mol
(4)将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图2所示(实验中始终保持V1+V2=50mL)
下列叙述正确的是B
A.做该实验时环境温度为22℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是1.0mol/L
D.该实验表明有水生成的反应都是放热反应.

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌器
(2)做1次完整的中和热测定实验,温度计需使用3次,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么?不同意,因为不同温度计误差不同
(3)该实验小组做了三次实验,每次取溶液各50mL,并记录如图原始数据.
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.7 | 6.7 |
| 2 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
| 3 | 25.1 | 25.1 | 25.1 | 33.6 | 8.5 |
△H=-56.8kJ/mol
(4)将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图2所示(实验中始终保持V1+V2=50mL)
下列叙述正确的是B
A.做该实验时环境温度为22℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是1.0mol/L
D.该实验表明有水生成的反应都是放热反应.
14.下列有关海水淡化的叙述不正确的是( )
| A. | 离子交换法淡化海水发生了化学变化 | |
| B. | 海水淡化可为人类提供更多的淡水资源 | |
| C. | 利用太阳能蒸发原理淡化海水属于物理变化 | |
| D. | 将海水中的盐分离出来不能达到海水淡化的目的 |
18.下列物质中,含有金属键的是( )
| A. | 干冰 | B. | 金刚石 | C. | 食盐 | D. | 白银 |
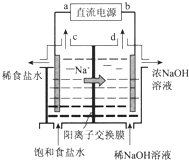 用石墨电极电解饱和NaCl溶液的装置如图所示,请回答:
用石墨电极电解饱和NaCl溶液的装置如图所示,请回答: 图是实验室制取某些气体的装置.
图是实验室制取某些气体的装置.