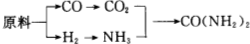题目内容
12.化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成: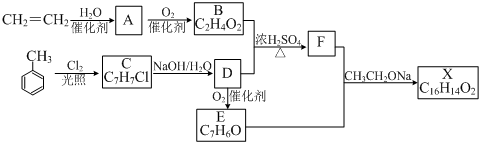
已知:RX$\stackrel{NaOH/H_{2}O}{→}$ROH;RCHO+CH3COOR′$\stackrel{CH_{3}CH_{2}ONa}{→}$RCH=CHCOOR′
请回答:
(1)E中官能团的名称是醛基.
(2)C→D的化学方程式
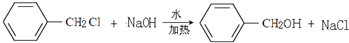 ,反应类型为水解反应或取代反应.
,反应类型为水解反应或取代反应.(3)B+D→F的化学方程式
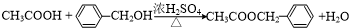 .
.(4)X的结构简式
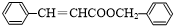 .
.(5)对于化合物X,下列说法正确的是AC.
A.能发生水解反应 B.不与浓硝酸发生取代反应
C.能使Br2/CCl4溶液褪色 D.能发生银镜反应
(6)写出一种同时符合下列条件的F的同分异构体,其结构简式为
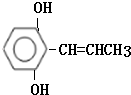 .
.①苯环上有三个侧链且苯环上一氯代物只有两种
②不能发生水解反应,遇FeCl3溶液显紫色
③能使溴水反应而褪色
④1moLF最多能和2molNa反应.
分析 乙烯与水在催化剂作用下发生加成反应生成乙醇,故A是CH3CH2OH,乙醇催化氧化最终生成CH3COOH,故B是CH3COOH;甲苯在光照条件下与氯气发生的是取代反应,则C为 ,C在氢氧化钠的水溶液中发生的是取代反应,那么D应为
,C在氢氧化钠的水溶液中发生的是取代反应,那么D应为 ,由D能被氧化为E,且结合给出的信息:RCHO+CH3COOR′$\stackrel{C{H}_{3}C{H}_{2}ONa}{→}$RCH=CHCOOR′,那么应E为
,由D能被氧化为E,且结合给出的信息:RCHO+CH3COOR′$\stackrel{C{H}_{3}C{H}_{2}ONa}{→}$RCH=CHCOOR′,那么应E为 ,据此推断得出F为:
,据此推断得出F为: ,那么X为
,那么X为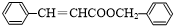 ,据此分析解答.
,据此分析解答.
解答 解:乙烯与水在催化剂作用下发生加成反应生成乙醇,故A是CH3CH2OH,乙醇催化氧化最终生成CH3COOH,故B是CH3COOH;甲苯在光照条件下与氯气发生的是取代反应,则C为 ,C在氢氧化钠的水溶液中发生的是取代反应,那么D应为
,C在氢氧化钠的水溶液中发生的是取代反应,那么D应为 ,由D能被氧化为E,且结合给出的信息:RCHO+CH3COOR′$\stackrel{C{H}_{3}C{H}_{2}ONa}{→}$RCH=CHCOOR′,那么应E为
,由D能被氧化为E,且结合给出的信息:RCHO+CH3COOR′$\stackrel{C{H}_{3}C{H}_{2}ONa}{→}$RCH=CHCOOR′,那么应E为 ,据此推断得出F为:
,据此推断得出F为: ,那么X为
,那么X为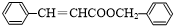 ,
,
(1)E为 ,E中官能团名称是醛基,故答案为:醛基;
,E中官能团名称是醛基,故答案为:醛基;
(2)C为 ,C在氢氧化钠的水溶液中发生的是取代反应,那么D应为
,C在氢氧化钠的水溶液中发生的是取代反应,那么D应为 ,反应方程式为
,反应方程式为 ,
,
该反应是水解反应或取代反应,
故答案为: ;水解反应或取代反应;
;水解反应或取代反应;
(3)该反应方程式为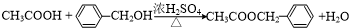 ,
,
故答案为: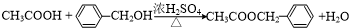 ;
;
(4)X结构简式为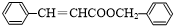 ,故答案为:
,故答案为: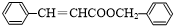 ;
;
(5)X为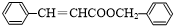 ,
,
A.X含有酯基,所以能发生水解反应,故正确;
B.含有苯环,在一定条件下能与浓硝酸发生取代反应,故错误;
C.含有碳碳双键,所以能和溴发生加成反应,则能使Br2/CCl4溶液褪色,故正确;
D.不含醛基,所以不能发生银镜反应,故错误;
故选AC;
(6)F为 ,
,
①苯环上有三个侧链且苯环上一氯代物只有两种,说明苯环上含有两种氢原子;
②不能发生水解反应,遇FeCl3溶液显紫色,说明含有酚羟基;
③能使溴水反应而褪色,说明含有碳碳双键;
④1moLF最多能和2molNa反应,则还含有1个羟基,
符合条件的一种同分异构体结构简式为 ,
,
故答案为: .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析判断能力,明确常见有机物结构和性质及反应条件、反应类型是解本题关键,注意结合题给信息采用知识迁移方法分析解答,难点是同分异构体结构简式确定.

 优加精卷系列答案
优加精卷系列答案| A. | X的最高正价比Y的小 | |
| B. | X的最高价氧化物一定是X2O,Y的气态氢化物为H2Y | |
| C. | X的离子半径比Y的大 | |
| D. | X的核电荷数比Y的小 |
①R元素的最高正价是+5价
②R元素还可形成其他含氧酸
③R元素原子的最外层电子数为7
④R元素的原子序数为7.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
 (PAN)等二次污染物.
(PAN)等二次污染物.
 +(n-1)H2O→n HOOCCH2CH(OH)COOH.
+(n-1)H2O→n HOOCCH2CH(OH)COOH.