题目内容
2.X元素的阳离子和Y元素的阴离子具有与氩元素相同的电子层结构.下列叙述正确的是( )| A. | X的最高正价比Y的小 | |
| B. | X的最高价氧化物一定是X2O,Y的气态氢化物为H2Y | |
| C. | X的离子半径比Y的大 | |
| D. | X的核电荷数比Y的小 |
分析 X元素的阳离子和Y元素的阴离子具有与氩元素相同的电子层结构,X元素处于第四周期、Y处于第三周期,X为金属元素,最外层电子数较少,Y为非金属元素,最外层电子数相对较多.
A.主族元素最高正化合价等于最外层电子数;
B.X阳离子不一定为+1阳离子,Y阴离子不一定为-2价;
C.电子层结构相同,核电荷数越大离子半径越小;
D.X元素处于第四周期、Y处于第三周期,X的核电荷数比Y的大.
解答 解:X元素的阳离子和Y元素的阴离子具有与氩元素相同的电子层结构,X元素处于第四周期、Y处于第三周期,X为金属元素,最外层电子数较少,Y为非金属元素,最外层电子数相对较多.
A.X原子最外层电子数小于Y原子的,故X的最高正价比Y的小,则A正确;
B.X阳离子不一定为+1阳离子,Y阴离子不一定为-2价,如X的氧化物为CaO、Y的氢化物为HCl,故B错误;
C.两离子电子层结构相同,原子序数X>Y,故离子半径:X<Y,故C错误;
D.X元素处于第四周期、Y处于第三周期,X的核电荷数比Y的大,故D错误.
故选:A.
点评 本题考查结构与位置的关系、微粒半径等,难度不大,关键根据离子具有相同的电子层结构推断元素的相对位置.

练习册系列答案
相关题目
13.前不久,我国科学家合成了三种新核素,其中一种是${\;}_{72}^{185}$Hf.下列关于${\;}_{72}^{185}$Hf的叙述中,正确的是( )
| A. | 该元素的原子序数是72 | B. | 该元素的原子序数是113 | ||
| C. | 该核素的中子数为72 | D. | 该元素的相对原子质量为了185 |
17.已知IIA元素由上至下依次是:Be、Mg、Ca、Sr、Ba、Ra;以同主族元素及其化合物性质的相似性为依据作出的下列判断不正确的( )
| A. | SrO可与盐酸反应 | B. | Sr(OH)2难溶于水 | C. | SrSO4难溶于水 | D. | Sr(OH)2是强碱 |
14.能正确表示下列反应的离子方程式为( )
| A. | 向FeI2溶液中滴入过量溴水:2Fe2++2I-+2Br2=2Fe3++I2+4Br- | |
| B. | NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | |
| C. | 用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| D. | 向FeCl3溶液中加入少量KSCN溶液:Fe3++3SCN-=Fe(SCN)3↓ |
11.下列原子中,半径最小的是( )
| A. | F | B. | Cl | C. | Al | D. | I |
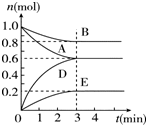 T℃、2L密闭容器中某一反应在不同时刻的各物质的量如图所示(E为固体,其余为气体).回答下列问题.
T℃、2L密闭容器中某一反应在不同时刻的各物质的量如图所示(E为固体,其余为气体).回答下列问题. ,B和D分别与强碱的醇溶液共热,都只能得到有机化合物E,以上反应及B的进一步反应如下所示,
,B和D分别与强碱的醇溶液共热,都只能得到有机化合物E,以上反应及B的进一步反应如下所示,
 4-甲基-1-戊炔
4-甲基-1-戊炔 3,3,4=三甲基己烷.
3,3,4=三甲基己烷.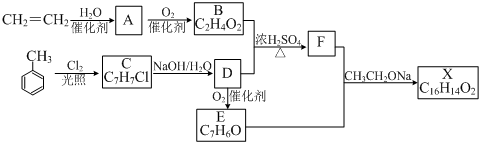
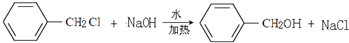 ,反应类型为水解反应或取代反应.
,反应类型为水解反应或取代反应.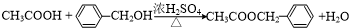 .
.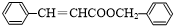 .
.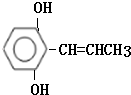 .
.