题目内容
13.如图1是元素周期表的一部分,按要求回答下列问题.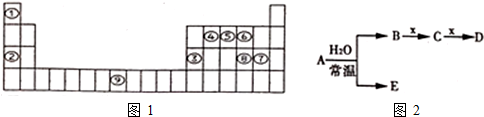
(1)Fe在元素周期表中位于四周期,第ⅤⅢ族.
(2)元素③、⑧、⑦最高价氧化物的水化物的酸性由强到弱排列的顺序为HClO4>H2SO4>Al(OH)3(填化合物的化学式).
(3)写出由元素①、⑥形成的既含极性键又含非极键的化合物的结构式H-O-O-H;M是⑦、⑧由元素形成的四原子分子,其各元素原子的最外层电子数满足8电子稳定结构,写出M的电子式
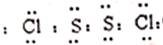 .
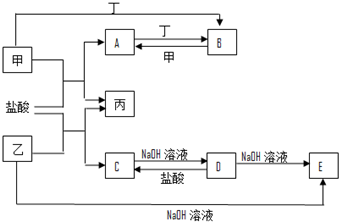
.(4)A、B、C、D、E、X是由上表给出的元素组成的单质或化合物,存在如图2转化关系(部分生成物和反应条件已略去).若E为氧化物,X为单质,则A与水反应的离子方程式为3NO2+2H2O=2H++2NO3-+NO,写出由B生成C的化学方程式Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,检验C中阳离子的最常见的试剂为KSCN溶液,当生成D的物质的量为0.3mol时,理伦上至少消耗A1.2 mol.
分析 (1)根据元素周期表的结构,确定①是H②是Na③是Al④是C⑤是N⑥是O⑦是Cl⑧是S⑨是Fe,据此回答;
(2)同周期,从左到右最高价含氧酸的酸性逐渐增强;
(3)双氧水是氧原子和氢原子之间、氧原子氧原子之间通过共价键形成的极性共价化合物,S、Cl原子之间形成的化合物是共价化合物;
(4)二氧化氮可以和水之间反应生成一氧化氮和硝酸,金属铁和稀硝酸之间反应得到硝酸铁、水以及一氧化氮,铁离子的检验用硫氰化钾,据此回答.
解答 解:根据元素周期表的结构,确定①是H②是Na③是Al④是C⑤是N⑥是O⑦是Cl⑧是S⑨是Fe,
(1)Fe在元素周期表中位于第四周期,第ⅤⅢ族,故答案为:四;ⅤⅢ;
(2)元素③是Al⑦是Cl⑧是S最高价氧化物的水化物分别是:Al(OH)3、HClO4、H2SO4,同周期,从左到右最高价含氧酸的酸性逐渐增强,酸性由强到弱顺序是HClO4>H2SO4>Al(OH)3,故答案为:HClO4>H2SO4>Al(OH)3;
(3)双氧水是氧原子和氢原子之间、氧原子氧原子之间通过共价键形成的极性共价化合物,其结构式为:H-O-O-H,S、Cl原子之间形成的化合物是共价化合物,原子的最外层都满足8电子的稳定结构,电子式为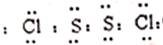 ,故答案为:H-O-O-H;
,故答案为:H-O-O-H;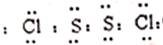 ;
;
(4)二氧化氮可以和水之间反应生成一氧化氮和硝酸3NO2+2H2O=2HNO3+NO,即3NO2+2H2O=2H++2NO3-+NO,所以E是NO,A是NO2,B是HNO3,X是Fe,D是硝酸亚铁,硝酸具有氧化性,可以和还原剂金属铁发生反应得到一氧化氮,发生的反应为:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,铁离子的检验用硫氰化钾溶液,当生成硝酸亚铁的物质的量为0.3mol时,根据反应:Fe+2Fe3+=3Fe2+,需要铁离子0.2mol,根据反应:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,消耗硝酸是0.8mol,根据反应3NO2+2H2O=2HNO3+NO,生成硝酸0.8mol,需要二氧化氮的物质的量是1.2mol,故答案为:3NO2+2H2O=2H++2NO3-+NO;Fe+4HNO3=Fe(NO3)3+NO↑+2H2O;KSCN溶液;1.2.
点评 本题考查元素周期表与元素周期律综合应用,侧重对基础知识的巩固,注意整体把握元素周期表的结构,比较基础.

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 对于可逆反应:mA(g)+nB(g)?xC(g);△H=?,在不同温度及压强条件下,反应物A的转化率如图所示,下列判断正确的是( )
对于可逆反应:mA(g)+nB(g)?xC(g);△H=?,在不同温度及压强条件下,反应物A的转化率如图所示,下列判断正确的是( )| A. | △H>0,m+n>x | B. | △H>0,m+n<x | C. | △H<0,m+n<x | D. | △H<0,m+n>x |
| A. | 金属钠保存在煤油中 | |
| B. | 白磷保存在水中 | |
| C. | 在FeCl3 溶液中加入一定量铁粉,防止溶液变质 | |
| D. | 为了检验FeCl2溶液是否变质,可用KSCN 溶液检验 |
| A. | 常温常压下,1mol氦气含有的核外电子数为4NA | |
| B. | 0.25mol Na2O2中含有的阴离子数为0.5NA | |
| C. | 50ml 18.4mol/L浓硫酸与足量铜微热,生成气体0.46NA | |
| D. | 25℃时,7g C2H4和C3H6的混合气体中,含有NA个C-H键 |
| A. | 前者大 | B. | 后者大 | C. | 相等 | D. | 无法确定 |
①封闭体系;②不做体积功其他功;③恒压;④恒温.
| A. | ②和④ | B. | ①和③ | C. | ①和② | D. | ①和④ |
 ;组成单质丁的元素的原子结构简图为
;组成单质丁的元素的原子结构简图为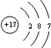 .
.