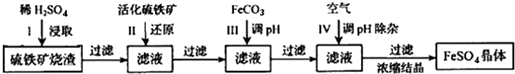
题目内容
5.设NA代表阿伏伽德罗常数的数值,则下列说法正确的是( )| A. | 常温常压下,1mol氦气含有的核外电子数为4NA | |
| B. | 0.25mol Na2O2中含有的阴离子数为0.5NA | |
| C. | 50ml 18.4mol/L浓硫酸与足量铜微热,生成气体0.46NA | |
| D. | 25℃时,7g C2H4和C3H6的混合气体中,含有NA个C-H键 |
分析 A.稀有气体为单原子分子,1mol氦气中含有1mol氦原子,含有2mol电子;
B.过氧化钠是由钠离子和过氧根离子构成分析;
C.浓硫酸和过量铜反应,浓硫酸随浓度减小成为稀硫酸后不与铜继续反应;
D.C2H4和C3H6的最简式均为CH2.
解答 解:A.1mol氦气分子中含有1mol氦原子,1mol氦原子中含有2mol电子,含有的核外电子数为2NA,故A错误;
B.过氧化钠是由钠离子和过氧根离子构成,0.25molNa2O2中含有的阴离子数为0.25NA,故B错误;
C.浓硫酸和过量铜反应,浓硫酸随浓度减小成为稀硫酸后不与铜继续反应,生成SO2分子数目小于0.46NA,故C错误;
D.C2H4和C3H6的最简式均为CH2,故7g混合物中含有的CH2的物质的量为n=$\frac{7g}{14g/mol}$=0.5mol,则含1molC-H键即NA条,故D正确.
故选D.
点评 本题考查阿伏加德罗常数的相关计算,注意物质的组成、结构、性质以及物质存在的外界条件和聚集状态等问题,注意过氧化钠是钠离子和过氧根离子构成,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.下列关于化学平衡的说法错误的是( )
| A. | 若改变影响化学平衡的条件之一,平衡向能够使这种改变减弱的方向移动 | |
| B. | 达到化学平衡时,各组分的浓度不再改变,反应停止 | |
| C. | 化学平衡移动,化学平衡常数不一定改变 |
17.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | pH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液的c(Na+):③>②>① | |
| B. | 0.2mol•L-1 CH3COOH溶液与0.1mol•L-1NaOH溶液等体积混合2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| C. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O═2HClO+CO32- | |
| D. | 常温下,向0.1mol/L NH4HSO4溶液中滴加NaOH溶液至中性c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) |
14.NA为阿伏加德罗常数,则下列说法正确的是( )
| A. | 已知C2H2(g)+$\frac{5}{2}$O2(g)→2CO2(g)+H2O(l)△H=-1300KJ/mol 当有5NA个电子转移时能放出650KJ的热量 | |
| B. | 有28g乙烯与丙烯混合气体,其含原子总数为3NA个 | |
| C. | 有反应H2(g)+I2(g)?2HI(g)△H=-QHJ/mol在298K 101KPa下向一密闭容器中充入NA个H2和NA个I2,充分反应共放出热量为QKJ | |
| D. | 在78g苯中含3NA个碳碳双键 |
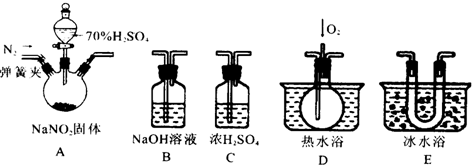
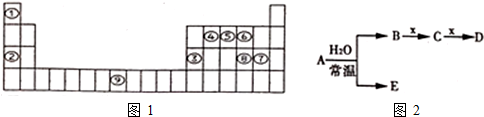
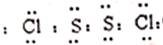 .
. 回答下列问题.
回答下列问题.