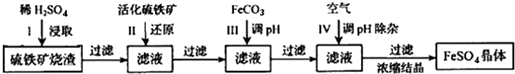
题目内容
2.指出在使用下列仪器(已经洗涤干净)或用品时的第一步操作:①石蕊试纸(检验气体):把试纸用蒸馏水湿润.
②容量瓶:检查容量瓶是否漏水.
③滴定管:检查滴定管是否漏水.
④集气瓶(收集氨气):干燥集气瓶.
⑤托盘天平:调节零点.
分析 (1)用石蕊试纸检验气体的酸碱性,需先用蒸馏水湿润试纸,溶解气体;
(2)容量瓶带有玻璃塞,配制溶液前需要检验是否漏水;
(3)滴定管带有玻璃活塞或玻璃珠,需检查滴定管是否漏水;
(4)氨气极易溶于水;
(5)托盘天平使用前需调0.
解答 解:(1)用石蕊试纸检验气体的酸碱性,需先用蒸馏水湿润试纸,溶解气体,故答案为:把试纸用蒸馏水湿润;
(2)容量瓶带有玻璃塞,配制溶液前需要检验是否漏水,故答案为:检查容量瓶是否漏水;
(3)酸式滴定管带有玻璃活塞,碱式滴定管带有玻璃珠,使用前均需检查滴定管是否漏水,故答案为:检查滴定管是否漏水;
(4)氨气极易溶于水,收集之前需干燥集气瓶,故答案为:干燥集气瓶;
(5)托盘天平使用前需要调0,故答案为:调节零点.
点评 本题主要考查了常见仪器的使用,注意仪器的特点以及使用方法是解题的关键,难度中等.

练习册系列答案
相关题目
15.下列说法正确的是( )
| A. | 16O和18O原子的核外电子排布不相同 | |
| B. | 含有离子键的化合物一定是离子化合物 | |
| C. | HF、HCl、HBr、HI的熔沸点逐渐升高 | |
| D. | 干冰和二氧化硅熔化时所克服微粒间的相互作用相同 |
17.下列关于化学平衡的说法错误的是( )
| A. | 若改变影响化学平衡的条件之一,平衡向能够使这种改变减弱的方向移动 | |
| B. | 达到化学平衡时,各组分的浓度不再改变,反应停止 | |
| C. | 化学平衡移动,化学平衡常数不一定改变 |
7.已知:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol.有关键能数据如下表:则水分子中O-H键能为( )
| 化学键 | H-H | O=O |
| 键能/kJ/mol | 436 | 498 |
| A. | 463.4kJ/mol | B. | 926.8kJ/mol | C. | 221.6kJ/mol | D. | 413kJ/mol |
11.氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用.
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视.它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势.氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H1
②4NH3(g)+6NO(g)═5N2(g)+6H2O(l)△H2
则反应 4NH3(g)+3O2(g)═2N2(g)+6H2O(l)△H=$\frac{3△H{\;}_{1}+2△H{\;}_{2}}{5}$.(请用含有△H1、△H2的式子表示)
(2)合成氨实验中,在体积为3L的恒容密闭容器中,投入4mol N2和9mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:
已知:破坏1mol N2(g)和3mol H2(g)中的化学键吸收的总能量小于形成2mol NH3(g)中的化学键放出的总能量.①则T1<T2(填“>”、“<”或“=”)
②在T2时,经过10min达到化学平衡状态,则0至10min内H2的平均反应速率v(H2)=0.1mol•L-1•min-1,平衡时N2的转化率α(N2)=25%.
③下列图象分别代表焓变(△H)、混合气体平均相对分子质量($\overline{M}$)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是BC.

(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视.它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势.氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H1
②4NH3(g)+6NO(g)═5N2(g)+6H2O(l)△H2
则反应 4NH3(g)+3O2(g)═2N2(g)+6H2O(l)△H=$\frac{3△H{\;}_{1}+2△H{\;}_{2}}{5}$.(请用含有△H1、△H2的式子表示)
(2)合成氨实验中,在体积为3L的恒容密闭容器中,投入4mol N2和9mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
②在T2时,经过10min达到化学平衡状态,则0至10min内H2的平均反应速率v(H2)=0.1mol•L-1•min-1,平衡时N2的转化率α(N2)=25%.
③下列图象分别代表焓变(△H)、混合气体平均相对分子质量($\overline{M}$)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是BC.

 ;反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O;已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.
;反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O;已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.
 密闭容器中,能说明反应:2N02(g)
密闭容器中,能说明反应:2N02(g) 2NO(g)+02(g)达到平衡
2NO(g)+02(g)达到平衡 状态的是 ( )
状态的是 ( )
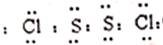 .
.