题目内容
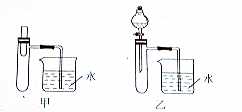
8.利用图1所示实验装置可以测定常温常压下气体的摩尔体积.
甲同学利用如图1装置,根据下列步骤完成实验:①装配好装置,作气密性检查.②用砂纸擦去镁带表面的氧化物,然后取0.108g的镁带.③取下A瓶加料口的橡皮塞,用小烧杯加入20mL水,再把已称量的镁带加到A瓶的底部,用橡皮塞塞紧加料口.④用注射器从A瓶加料口处抽气,使B瓶导管内外液面持平.⑤用注射器吸取10mL3mol•L-1硫酸溶液,用针头扎进A瓶加料口橡皮塞,将硫酸注入A瓶,注入后迅速拔出针头.⑥当镁带完全反应后,读取C瓶中液体的体积,记录数据.⑦用注射器从A瓶加料口处抽出8.0mL气体,使B瓶中导管内外液面持平.⑧读出C瓶中液体体积是115.0mL.完成下列填空:
(1)常温常压下的压强为101KPa,温度为25℃.
(2)在常温常压下气体摩尔体积理论值约为24.5L/mol,甲同学测出此条件下lmol气体的体积为25.1L,计算此次实验的相对误差为+2.5%(保留2位有效数字).引起该误差的可能原因是ac.
a.镁带中含铝;b.没有除去镁带表面的氧化物;c.反应放热;d.所用硫酸的量不足
(3)丙同学提出可用如图2装置完成该实验.该装置气密性的检查方法是:从水准管中加入水,快速上移或下移水准管,若量气管内液面最终与水准管液面存在稳定的液面差即气密性良好.
(4)与原方案装置相比,丙同学使用的装置实验精度更高.请说明理由(回答两条)该装置能更简便、更准确地控制气压不变,量气管由滴定管改制,读数更精确.
分析 (1)常温常压是指25℃,101KPa;
(2)加入的硫酸溶液体积也计算在量气瓶中的液体体积,反应后抽出的气体体积调整液面平衡,所以需要在气体体积中加入抽出气体的体积,可得生成氢气的体积为,根据Mg的质量计算生成氢气物质的量,进而计算气体摩尔体积;
相对误差是指测量所造成的绝对误差与真值之比,再乘以100%所得的数值;
反应放热,气体体积热胀冷缩,Mg中含有Al时,生成氢气体积偏大,导致测定值偏大,没有除去镁带表面的氧化物、所用硫酸的量不足,导致生成氢气体积偏小,导致测定值偏小;
(3)利用液封气体,形成量气管内与水准管内液面存高度差,一定时间内液面差不变,说明气密性良好;
(4)与图1相比,该装置能更简便、更准确地控制气压不变;量气管由滴定管改制,读数更精确等.
解答 解:(1)常温常压下的压强为101KPa,温度为25℃,
故答案为:101KPa;25℃;
(2)生成氢气的体积为115mL-10mL+8mL=113mL,0.108gMg完全反应得到氢气为$\frac{0.108g}{24g/mol}$=0.0045mol,可得气体摩尔体积为$\frac{0.113L}{0.0045mol}$=25.1mol/L,相对误差为$\frac{25.1mol/L-24.5mol/L}{24.5mol/L}$×100%=+2.5%,
反应放热,气体体积热胀冷缩,Mg中含有Al时,生成氢气体积偏大,导致测定值偏大,没有除去镁带表面的氧化物、所用硫酸的量不足,导致生成氢气体积偏小,导致测定值偏小,故选ac,
故答案为:25.1L;+2.5;ac;
(3)该装置气密性的检查方法是:从水准管中加入水,快速上移或下移水准管,若量气管内液面最终与水准管液面存在稳定的液面差即气密性良好,
故答案为:从水准管中加入水,快速上移或下移水准管,若量气管内液面最终与水准管液面存在稳定的液面差即气密性良好;
(4)与图1相比,该装置能更简便、更准确地控制气压不变,借助水浴装置,实验温度更接近常温(水浴能减小反应放热带来的误差),量气管由滴定管改制,读数更精确,
故答案为:该装置能更简便、更准确地控制气压不变;量气管由滴定管改制,读数更精确等.
点评 本题考查定量测定实验,涉及气体摩尔体积的测定,关键是理解测定原理计算生成氢气的体积,较好的考查学生分析计算能力.

①m+4 ②m-4 ③m-8 ④m+2⑤m-6 ⑥m+12.
| A. | ①②③ | B. | ①④⑤⑥ | C. | ①②③④⑤ | D. | ①②③④⑤⑥ |
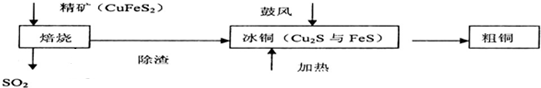
| A. | 焙烧时硫元素全部转化为二氧化硫 | B. | 在焙烧时氧化剂只有氧气 | ||
| C. | 粗铜精炼时用粗铜做阴极 | D. | Cu2S可用于火法炼制铜 |
| A. | 各元素的最高正化合价跟族的序数相等 | |
| B. | 所有元素都有正化合价和负化合价,它们的绝对值之和等于8 | |
| C. | 非金属元素的负化合价,等于原子最外层达到8个电子稳定结构所需得到的电子数 | |
| D. | 各元素原子的最外层电子数跟族序数相等 |
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A. | 等物质的量浓度的各溶液 pH 关系为:pH ( NaCN)>pH(Na2CO3)>pH( CH3COONa) | |
| B. | 浓度均为0.2mol/L NaHCO3和 Na2CO3溶液中,存在的粒子种类不相同 | |
| C. | 0.4 mol•L-1HCN 溶液与 0.2 mol•L-1NaOH 溶液等体积混合后,所得溶液中:c(Na+)>c(OH-)>c(H+) | |
| D. | 25℃时,pH=4且浓度均为0.1 mol•L-1的 CH3COOH、CH3COONa混合溶液中:c(Na+)+c(H+)>c(CH3COO-)+c(CH3COOH) |