题目内容
14.氯化银在溶液中有极微量的电离:AgCl(s)?Ag+(aq)+Cl-(aq).不能说明该电离达到平衡状态的是( )| A. | Ag+的浓度不再改变 | |
| B. | Ag+的生成速率和Ag+、Cl-结合生成AgCl的速率相等 | |
| C. | AgCl的质量不再减少 | |
| D. | Ag+与Cl-的物质的量比为1:1 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、Ag+的浓度不再改变,说明正逆反应速率相等,电离达平衡状态,故A正确;
B、Ag+的生成速率和Ag+,等效于AgCl生成Cl-的速率,与Cl-结合生成AgCl的速率相等,正逆反应速率相等,电离达平衡状态,故B正确;
C、AgCl的质量不再减少,说明电离达平衡状态,故C正确;
D、只要反应发生就符合,Ag+与Cl-的物质的量比为1:1,不能说明该电离达到平衡状态,故D错误;
故选D.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
4.下列说法正确的是( )
| A. | 分子式为C9H10且含有碳碳双键的芳香烃有5种 | |
| B. | 结构为…-CH═CH-CH═CH-CH═CH-…的高分子化合物,其单体是乙烯 | |
| C. | 三分子甲醛合成三聚甲醛( )的反应属于加成反应 )的反应属于加成反应 | |
| D. | 丙烯酸(CH2═CHCOOH)和山梨酸(CH3CH═CHCH═CHCOOH)不是同系物,它们与氢气充分反应后的产物也不是同系物 |
5.可判断某溶液呈中性的依据是( )
| A. | 溶液的c(H+)=10-7 mol/L | B. | 溶液的溶质为盐 | ||
| C. | 溶液中既含有H+又含有OH- | D. | 混合溶液中,pH=-$\frac{lg{K}_{w}}{2}$ |
2.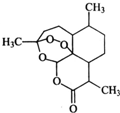 中国女科学家屠呦呦因为发现青蒿素获颁诺贝尔医学奖.图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )
中国女科学家屠呦呦因为发现青蒿素获颁诺贝尔医学奖.图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )
 中国女科学家屠呦呦因为发现青蒿素获颁诺贝尔医学奖.图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )
中国女科学家屠呦呦因为发现青蒿素获颁诺贝尔医学奖.图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )| A. | 有“-O-”键,分子式C15H22O5,可发生取代反应 | |
| B. | 有“六元环”结构,是苯的同系物,可发生加成反应 | |
| C. | 有“-O-O-”键,氧化性较强,可发生还原反应 | |
| D. | 有“-COOC-”键,碱性条件下,可发生水解反应 |
9.常温下,下列有关叙述正确的是( )
| A. | 0.1 mol/L的CH3COOH溶液和0.1 mol/L的CH3COONa溶液等体积混合c(CH3COO-)+c(OH-)=c(Na+)+c(H+) | |
| B. | 同浓度的①NH4C1、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序为:①=②>③ | |
| C. | Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 10mLpH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20mL |
19.下列有机物的分子中,所有的碳原子一定不能处于同一平面上的是( )
| A. | CH3CH2CH3 | B. | CH2═CH-CH═CH2 | C. |  | D. | (CH3)3C-CH═CHCH3 |
6.已知: ,其中甲、乙、丁均能发生银镜反应,则乙为( )
,其中甲、乙、丁均能发生银镜反应,则乙为( )
 ,其中甲、乙、丁均能发生银镜反应,则乙为( )
,其中甲、乙、丁均能发生银镜反应,则乙为( )| A. | 甲醇 | B. | 甲醛 | C. | 乙醛 | D. | 甲酸 |
3.下列描述中正确的是( )
| A. | CS2为V形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | CO32-VSEPR模型名称与离子的立体构型名称不一致 | |
| D. | SiF4和SO32-的中心原子均为sp3杂化 |