题目内容
9.常温下,下列有关叙述正确的是( )| A. | 0.1 mol/L的CH3COOH溶液和0.1 mol/L的CH3COONa溶液等体积混合c(CH3COO-)+c(OH-)=c(Na+)+c(H+) | |
| B. | 同浓度的①NH4C1、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序为:①=②>③ | |
| C. | Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 10mLpH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20mL |
分析 A.依据溶液中电荷守恒分析判断,溶液中阴阳离子所带电荷总数相同;
B.等浓度的②(NH4)2SO4溶液、①NH4Cl溶液中铵根离子浓度②>①,③NH4HSO4溶液中电离出的氢离子抑制铵根离子水解,据此判断;
C.Na2CO3溶液中存在物料守恒,n(Na)=2n(C),钠元素物质的量浓度等于碳元素所有存在形式浓度总和;
D.A.如果HA是强酸,当溶液的pH=7,HA体积为10mL,如果HA是弱酸,当溶液的pH=7时,HA体积小于10mL;
解答 解:A.0.1 mol/L的CH3COOH溶液和0.1 mol/L的CH3COONa溶液等体积混合,溶液中存在电荷守恒,c(CH3COO-)+c(OH-)=c(Na+)+c(H+),故A正确;
B.同温下,等浓度的①NH4Cl溶液、②(NH4)2SO4溶液、③NH4HSO4溶液中①NH4Cl溶液、②(NH4)2SO4溶液中铵根离子浓度②>①,②>③,③NH4HSO4溶液中电离出的氢离子抑制铵根离子水解,溶液中铵根离子浓度③>①,则溶液中铵根离子浓度大小为②>③>①,故B错误;
C..Na2CO3溶液中存在物料守恒,n(Na)=2n(C),c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故C错误;
D.如果HA是强酸,当溶液的pH=7,HA体积为10mL,如果HA是弱酸,当溶液的pH=7时,HA体积小于10mL,所以所得溶液的总体积V≤20ml,故D错误;
故选A.
点评 本题考查了盐类水解、弱电解质电离平衡、电解质溶液中电荷守恒和物料守恒发信息判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
19.化学与社会、生产、生活密切相关.下列说法不正确的是( )
| A. | 可以选用乙醇与碘化钾淀粉试纸来证明食盐中存在IO3- | |
| B. | 维生素C能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+ | |
| C. | 农药波尔多液不能用铁制容器盛放,是因为铁能与该农药中的硫酸铜起反应 | |
| D. | 不法分子有时用铜锌合金制成假金币行骗,我们可以通过滴加硝酸在币的表面,观察现象从而鉴别其真假 |
4.某一化合物的分子式为AB2,A属ⅥA族元素,B属ⅦA族元素,A和B在同一周期,它们的电负性分别为3.44和3.98,已知AB2分子的键角为103.3°.下列推断不正确的是( )
| A. | AB2分子的空间构型为V形 | |
| B. | AB2与H2O相比,AB2的熔、沸点比H2O的低 | |
| C. | AB2分子中无氢原子,分子间不能形成氢键,而H2O分子间能形成氢键 | |
| D. | A-B键为极性共价键,AB2分子为非极性分子 |
14.氯化银在溶液中有极微量的电离:AgCl(s)?Ag+(aq)+Cl-(aq).不能说明该电离达到平衡状态的是( )
| A. | Ag+的浓度不再改变 | |
| B. | Ag+的生成速率和Ag+、Cl-结合生成AgCl的速率相等 | |
| C. | AgCl的质量不再减少 | |
| D. | Ag+与Cl-的物质的量比为1:1 |
1.下列实验能获得成功的是( )
| A. | 氯乙烷与NaOH溶液共热,在反应后的溶液中加入AgNO3溶液检验Cl- | |
| B. | 在淀粉加入硫酸加热水解后的溶液中,直接加入银氨溶液,水浴加热,检验葡萄糖的生成 | |
| C. | 1 mol•L-1 CuSO4溶液2 mL和0.5 mol•L-1 NaOH溶液4 mL混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色 | |
| D. | 配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加,直至沉淀刚好溶解为止 |
18.关于有机物说法正确是的( )
| A. | 有机物可分烃和烃的衍生物 | |
| B. | 含C化合物就是有机物 | |
| C. | 有机物都不溶于水,但易溶于有机溶剂 | |
| D. | 有机物都能燃烧 |
13.下列实验中,所选装置不合理的是( )
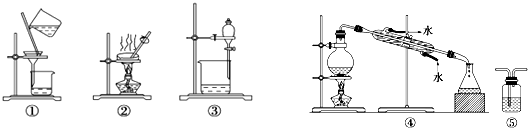

| A. | 用CCl4提取碘水中的碘,选③ | |
| B. | 用KMnO4溶液检验CH4是否含有C2H4,选⑤ | |
| C. | 粗盐提纯,选①和② | |
| D. | 石油的分馏,选④ |
 坩埚;
坩埚; 泥三角.
泥三角.