题目内容
5.可判断某溶液呈中性的依据是( )| A. | 溶液的c(H+)=10-7 mol/L | B. | 溶液的溶质为盐 | ||
| C. | 溶液中既含有H+又含有OH- | D. | 混合溶液中,pH=-$\frac{lg{K}_{w}}{2}$ |
分析 溶液的酸碱性是根据溶液中氢离子浓度和氢氧根离子浓度的相对大小判断的,
当溶液中c(H+)>c(OH-)时,溶液呈酸性;
当溶液中c(H+)=c(OH-)时,溶液呈中性;
当溶液中c(H+)<c(OH-)时,溶液呈碱性,
注意不能根据溶液的pH值大小判断.
解答 解:A.常温下溶液的c(H+)=10-7 mol/L时溶液呈中性,温度升高水的电离程度增大,溶液PH减小,PH=7可能呈碱性,故A错误;
B.溶液中溶质为强酸强碱正盐溶液显中性,但有弱离子的盐会水解使溶液显示酸碱性,故B错误;
C.水溶液中一定存在水的电离平衡,酸、碱溶液中都含有氢离子和氢氧根离子,故C错误;
D.混合溶液中PH=-$\frac{lgKw}{2}$=-$\frac{lgc({H}^{+})c(O{H}^{-})}{2}$=-lgc(H+),得到c(H+)=c(OH-),溶液显中性,故D正确;
故选D.
点评 本题考查溶液酸碱性的判断、溶液PH计算,该题是常识性知识的考查,难度不大,该题的关键是明确溶液酸碱性的判断依据,注意溶液的酸碱性是根据溶液中氢离子浓度和氢氧根离子浓度的相对大小判断的,本题有利于培养学生的逻辑推理能力和灵活应变能力.

练习册系列答案
相关题目
15.已知OCN-中C显+4价,在反应OCN-+OH-+Cl2→CO2+N2+Cl-+H2O(未配平)中,如果有6mol Cl2完全反应,则被氧化的OCN-的物质的量是( )
| A. | 2 mol | B. | 3 mol | C. | 6mol | D. | 4 mol |
13.下列有关表述正确的是( )
| A. | 离子晶体一定含金属阳离子 | |
| B. | 非金属元素形成的单质一定是分子晶体 | |
| C. | 在共价化合物分子中各原子都形成8电子结构 | |
| D. | 共价键能存在于共价化合物中,也能存在于离子化合物中 |
14.氯化银在溶液中有极微量的电离:AgCl(s)?Ag+(aq)+Cl-(aq).不能说明该电离达到平衡状态的是( )
| A. | Ag+的浓度不再改变 | |
| B. | Ag+的生成速率和Ag+、Cl-结合生成AgCl的速率相等 | |
| C. | AgCl的质量不再减少 | |
| D. | Ag+与Cl-的物质的量比为1:1 |
 坩埚;
坩埚; 泥三角.
泥三角. HCO3-+OH-;相同浓度的Na2CO3溶液与NaHCO3溶液等体积混合后,溶液中c(HCO3-)>c(CO32-)(用“>、<、=”表示).
HCO3-+OH-;相同浓度的Na2CO3溶液与NaHCO3溶液等体积混合后,溶液中c(HCO3-)>c(CO32-)(用“>、<、=”表示).
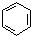
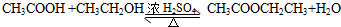 .
.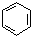 在浓硫酸作用下,与浓硝酸反应的化学方程式为
在浓硫酸作用下,与浓硝酸反应的化学方程式为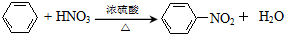 .
.