题目内容
6.已知: ,其中甲、乙、丁均能发生银镜反应,则乙为( )
,其中甲、乙、丁均能发生银镜反应,则乙为( )| A. | 甲醇 | B. | 甲醛 | C. | 乙醛 | D. | 甲酸 |
分析 由转化可知,甲能被氧化,也能被还原,且甲、乙、丁均能发生银镜反应,则甲为HCHO,丁为甲酸甲酯,以此来解答.
解答 解:由转化可知,甲能被氧化,也能被还原,且甲、乙、丁均能发生银镜反应,则均含-CHO,乙与丙发生酯化反应生成丁为甲酸甲酯,则甲为HCHO,乙为HCOOH,丙为甲醇,
故选D.
点评 本题考查有机物的推断,为高频考点,把握甲为甲醛、且甲、乙、丁均含-CHO为解答的关键,侧重分析与推断能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.氯化银在溶液中有极微量的电离:AgCl(s)?Ag+(aq)+Cl-(aq).不能说明该电离达到平衡状态的是( )
| A. | Ag+的浓度不再改变 | |
| B. | Ag+的生成速率和Ag+、Cl-结合生成AgCl的速率相等 | |
| C. | AgCl的质量不再减少 | |
| D. | Ag+与Cl-的物质的量比为1:1 |
1.下列实验能获得成功的是( )
| A. | 氯乙烷与NaOH溶液共热,在反应后的溶液中加入AgNO3溶液检验Cl- | |
| B. | 在淀粉加入硫酸加热水解后的溶液中,直接加入银氨溶液,水浴加热,检验葡萄糖的生成 | |
| C. | 1 mol•L-1 CuSO4溶液2 mL和0.5 mol•L-1 NaOH溶液4 mL混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色 | |
| D. | 配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加,直至沉淀刚好溶解为止 |
11.某原电池反应原理如图所示,下列有关该原电池的说法正确的是( )
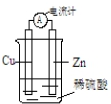

| A. | 电子从锌片经导线流向铜片 | B. | H+向负极移动 | ||
| C. | 一段时间后,铜片质量减轻 | D. | 锌片发生还原反应 |
18.关于有机物说法正确是的( )
| A. | 有机物可分烃和烃的衍生物 | |
| B. | 含C化合物就是有机物 | |
| C. | 有机物都不溶于水,但易溶于有机溶剂 | |
| D. | 有机物都能燃烧 |
10.为了更好的掌握周期表的应用,某同学在做氯、溴、碘性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象
请你帮助该同学整理并完成实验报告.
(1)实验目的:研究同主族元素性质递变规律.
(2)实验用品:试剂:氯水,溴水,NaBr溶液,KI溶液,CCl4溶液
玻璃仪器:①试管②胶头滴管.
(3)此实验的结论为同主族元素从上到下随原子序数递增非金属递减.
(4)氟氯溴碘气态氢化物稳定性大小顺序(用分子式表示):HF>HCl>HBr>HI.
(5)该同学又做了另外一个实验,向新制得的Na2S溶液中滴加新制的氯水.该实验现象为生成淡黄色沉淀.
此反应的离子方程式Cl2+S2-=S↓+2Cl-.
此实验的结论为氧化性Cl2>S.
| 实验步骤 | 实验现象[ |
| ①将少量的氯水滴入到适量NaBr溶液中,再滴入少量的CCl4溶液并用力振荡 | A.溶液分为上下两层,上层为无色,下层为橙红色 |
| ②将少量的溴水滴入到适量KI溶液中,再滴入少量的CCl4溶液并用力振荡 | B.溶液分为上下两层,上层为无色,下层为紫红色 |
(1)实验目的:研究同主族元素性质递变规律.
(2)实验用品:试剂:氯水,溴水,NaBr溶液,KI溶液,CCl4溶液
玻璃仪器:①试管②胶头滴管.
(3)此实验的结论为同主族元素从上到下随原子序数递增非金属递减.
(4)氟氯溴碘气态氢化物稳定性大小顺序(用分子式表示):HF>HCl>HBr>HI.
(5)该同学又做了另外一个实验,向新制得的Na2S溶液中滴加新制的氯水.该实验现象为生成淡黄色沉淀.
此反应的离子方程式Cl2+S2-=S↓+2Cl-.
此实验的结论为氧化性Cl2>S.

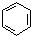
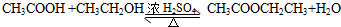 .
.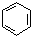 在浓硫酸作用下,与浓硝酸反应的化学方程式为
在浓硫酸作用下,与浓硝酸反应的化学方程式为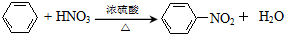 .
.