题目内容
18.某校化学兴趣小组在加热条件下利用二氧化锰与浓盐酸反应来制取并收集氯气.(1)写出该反应的化学方程式MnO2+4HCl-$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)若要制取纯净干燥的氯气,应使气体依次通过装有饱和食盐水和浓硫酸的洗气瓶.
(3)该小组称取8.7g二氧化锰与足量10mol•L-1的浓盐酸反应,理论上可制得氯气的体积(标准状况)V1=22.4L.
(4)若该小组量取了10mol•L-1的浓盐酸40mL,与足量的二氧化锰反应,理论上产生氯气的体积为V2(标准状况),则V1>V2(填“>”、“=”或“<”)
分析 (1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、水和氯气;
(2)氯气中混有水蒸气和HCl,可用浓硫酸干燥,用饱和食盐水除去氯化氢;
(3)根据二氧化锰和氯气的关系式计算生成氯气的体积;
(4)浓盐酸具有较强的还原性,可与二氧化锰发生氧化还原反应,但稀盐酸不反应.
解答 解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、水和氯气,反应为MnO2+4HCl-$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl-$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)浓盐酸有挥发性,浓盐酸、水在加热时会产生气体,所以氯气中含有氯化氢、水蒸气;氯化氢极易溶于水,且饱和食盐水中含有氯离子,抑制氯气的溶解,所以饱和食盐水的作用是吸收氯化氢气体;浓硫酸有吸水性,所以其作用是除水蒸气,
故答案为:饱和食盐水;浓硫酸;
(3)设理论上可制得氯气的体积(标准状况)V1,
MnO2+4HCl-$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
87g 22.4L
8.7g V1
所以 V1=2.24 L
故答案为:22.4;
(4)10mol•L-1的浓盐酸40mL,n(HCl)=0.4mol,与足量的二氧化锰反应,因为浓盐酸和二氧化锰反应生成氯气,稀盐酸和二氧化锰不反应,所以随着反应的进行,浓盐酸变成稀盐酸,反应不再进行,故V2<V1,
故答案为:>.
点评 本题考查了氯气的实验室制法等知识点,侧重于学生的分析、计算能力的考查,难度不大,注意浓盐酸和二氧化锰能反应生成氯气,稀盐酸和二氧化锰不反应.

| A. | Ag+的浓度不再改变 | |
| B. | Ag+的生成速率和Ag+、Cl-结合生成AgCl的速率相等 | |
| C. | AgCl的质量不再减少 | |
| D. | Ag+与Cl-的物质的量比为1:1 |
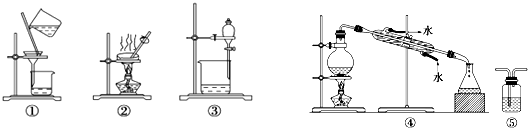
| A. | 用CCl4提取碘水中的碘,选③ | |
| B. | 用KMnO4溶液检验CH4是否含有C2H4,选⑤ | |
| C. | 粗盐提纯,选①和② | |
| D. | 石油的分馏,选④ |
| 实验步骤 | 实验现象[ |
| ①将少量的氯水滴入到适量NaBr溶液中,再滴入少量的CCl4溶液并用力振荡 | A.溶液分为上下两层,上层为无色,下层为橙红色 |
| ②将少量的溴水滴入到适量KI溶液中,再滴入少量的CCl4溶液并用力振荡 | B.溶液分为上下两层,上层为无色,下层为紫红色 |
(1)实验目的:研究同主族元素性质递变规律.
(2)实验用品:试剂:氯水,溴水,NaBr溶液,KI溶液,CCl4溶液
玻璃仪器:①试管②胶头滴管.
(3)此实验的结论为同主族元素从上到下随原子序数递增非金属递减.
(4)氟氯溴碘气态氢化物稳定性大小顺序(用分子式表示):HF>HCl>HBr>HI.
(5)该同学又做了另外一个实验,向新制得的Na2S溶液中滴加新制的氯水.该实验现象为生成淡黄色沉淀.
此反应的离子方程式Cl2+S2-=S↓+2Cl-.
此实验的结论为氧化性Cl2>S.
| A. | 在25℃时,将c mol•L-1的醋酸溶液与0.02mol•L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=$\frac{2×{10}^{-9}}{c-0.02}$ | |
| B. | 0.1 mol•L-1醋酸溶液中:c(H+)2=c (H+)•c(CH3COO-)+KW | |
| C. | 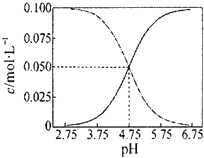 常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示,当pH=4.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 等体积等物质的量浓度的CH3COONa(aq)与NaCl(aq)中离子总数大小:N前>N后 |
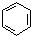
| A. | 苯不能使酸性KMnO4溶液褪色,属于饱和烃 | |
| B. | 常温下苯是一种易溶于水且密度比水小的液体 | |
| C. | 苯不具有典型的双键,故苯不能发生加成反应 | |
| D. | 苯分子为平面正六边形结构,6个碳原子之间的价键完全相同 |
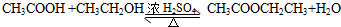 .
.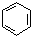 在浓硫酸作用下,与浓硝酸反应的化学方程式为
在浓硫酸作用下,与浓硝酸反应的化学方程式为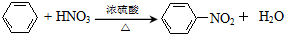 .
. 下列给出了四种烃A、B、C、D的相关信息:
下列给出了四种烃A、B、C、D的相关信息: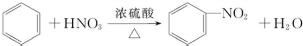 .
.