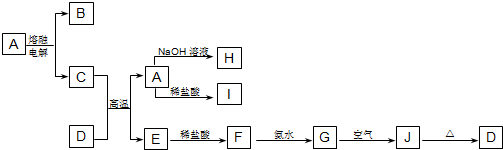
题目内容
将16g Cu与一定量的浓硫酸加热后,恰好完全反应,反应方程式如下:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
问:(1)得到SO2气体的体积(标准状况下)是多少?
(2)求被还原的硫酸质量
(2)把所得的CuSO4配制成500mL CuSO4溶液,求所得溶液中溶质的物质的量浓度.
| ||
问:(1)得到SO2气体的体积(标准状况下)是多少?
(2)求被还原的硫酸质量
(2)把所得的CuSO4配制成500mL CuSO4溶液,求所得溶液中溶质的物质的量浓度.
考点:氧化还原反应的计算
专题:
分析:n(Cu)=
=0.25mol,结合反应的方程式计算相关物理量:
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
1mol 2mol 1mol 22.4L
0.25mol n(H2SO4) n(CuSO4) V,以此计算.
| 16g |
| 64g/mol |
Cu+2H2SO4(浓)
| ||
1mol 2mol 1mol 22.4L
0.25mol n(H2SO4) n(CuSO4) V,以此计算.
解答:
解:n(Cu)=
=0.25mol,
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
1mol 2mol 1mol 22.4L
0.25mol n(H2SO4) n(CuSO4) V
(1)V=
=5.6,答:生成的SO2的体积为5.6L;
(2)n(H2SO4)=
=0.5mol,其中被还原的硫酸为0.25mol,质量为0.25mol×98g/mol=24.5g,答:被还原的硫酸质量为24.5g;
(3)n(CuSO4)=0.25mol,则c(CuSO4)=
=0.5mol/L,答:硫酸铜溶液的物质的量浓度为0.5 mol?L-1.
| 16g |
| 64g/mol |
Cu+2H2SO4(浓)
| ||
1mol 2mol 1mol 22.4L
0.25mol n(H2SO4) n(CuSO4) V
(1)V=
| 0.25mol×22.4L |
| 1mol |
(2)n(H2SO4)=
| 0.25mol×2mol |
| 1mol |
(3)n(CuSO4)=0.25mol,则c(CuSO4)=
| 0.25mol |
| 0.5L |
点评:本题考查化学方程式的计算,侧重于学生的分析和计算能力的考查,为高频考点,注意相关计算公式的运用,难度不大.

练习册系列答案
相关题目
将0.5molFeCl2加入KMnO4溶液中,恰好使溶液中Fe2+全部转化为Fe3+,则溶液中KMnO4的物质的量为( )
| A、0.1mol |
| B、0.2mol |
| C、0.3mol |
| D、0.4mol |
 锂空气电池是一种用锂作负极,以空气中的氧气作为正极反应物的电池.其比锂离子电池具有更高的能量密度,具有很广阔的应用前景.其工作原理如图,下列说法中正确的是( )
锂空气电池是一种用锂作负极,以空气中的氧气作为正极反应物的电池.其比锂离子电池具有更高的能量密度,具有很广阔的应用前景.其工作原理如图,下列说法中正确的是( )| A、电池工作时电子从A流向B,再由B经电池内 部流向A,形成闭合回路 |
| B、电池总反应为4Li+O2=2Li2O(Li2O不溶于水) |
| C、该电池只需更换负极材料和水性电解液,可以长期供电 |
| D、用该电池电解精炼铜,理论上消耗7g锂,可以得到64g铜 |
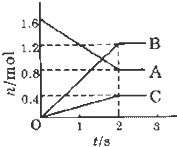 某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为
某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为