题目内容
14.对下列实验操作和现象所作出的实验结论正确的是( )| 实验操作和现象 | 实验结论 | |
| A | SO2通入Ba(NO3)2溶液中有白色沉淀生成 | 白色沉淀是BaSO3 |
| B | 向某待检液中滴加盐酸酸化的BaCl2溶液,生成白色沉淀 | 该待检液中可能不含有SO42- |
| C | 将FeCl3溶液分别滴入NaBr、NaI溶液中,再分别滴加CCl4,振荡,静置,下层分别呈无色和紫红色 | 氧化性:Fe3+>Br2>I2 |
| D | 向浓度均为0.1mol/L的KCl、KI混合液中滴加1~2滴0.01mol/LAgNO3溶液,产生黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
分析 A.SO2通入Ba(NO3)2溶液中,发生氧化还原反应生成硫酸钡;
B.白色沉淀为AgCl或硫酸钡;
C.下层分别呈无色和紫红色,可知铁离子与碘离子发生氧化还原反应;
D.Ksp小的先沉淀.
解答 解:A.SO2通入Ba(NO3)2溶液中,发生氧化还原反应生成硫酸钡,则白色沉淀是BaSO4,故A错误;
B.白色沉淀为AgCl或硫酸钡,则溶液中可能含银离子或硫酸根离子,但二者不能同时存在,故B正确;
C.下层分别呈无色和紫红色,可知铁离子与碘离子发生氧化还原反应生成碘,而与溴离子不反应,则氧化性:Br2>Fe3+>I2,故C错误;
D.Ksp小的先沉淀,先生成的黄色沉淀为AgI,则Ksp(AgCl)>Ksp(AgI),故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握氧化还原反应、离子检验、沉淀的生成、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.下列离子方程式正确的是( )
| A. | 硫酸氢钠溶液和过量的Ba(OH)2溶液反应SO42-+H++Ba2++OH-=BaSO4↓+H2O | |
| B. | 碳酸氢钠水解:HCO3-+H2O=CO32-+H3O+ | |
| C. | 氯气和水反应:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 用铂电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- |
6.下列实验操作中,所用仪器合理的是( )
| A. | 在蒸发皿中放入NaCl溶液,加热、蒸发得到NaCl晶体 | |
| B. | 用10 mL的量筒量取5.2 mL的盐酸 | |
| C. | 用托盘天平称取25.20 g NaCl | |
| D. | 用1 000 mL容量瓶配制450 mL 0.1 mol•L-1的盐酸 |
4.化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A. | Na2CO3俗称纯碱,属于盐类,可用于洗涤油污等 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | MgO的熔点很高,可用于制作耐高温材料 | |
| D. | 电解MgCl2饱和溶液,可制得金属镁 |
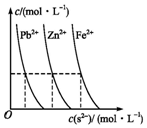 平衡指的是两个相反方向的变化最后所处的运动状态;中学阶段涉及的平衡有气体可逆反应的平衡、酸碱电离平衡、水解平衡及沉淀-溶解平衡等.
平衡指的是两个相反方向的变化最后所处的运动状态;中学阶段涉及的平衡有气体可逆反应的平衡、酸碱电离平衡、水解平衡及沉淀-溶解平衡等.