题目内容
3.实验室现需配制100mL 2.00mol/L的氯化钠溶液.(1)称量氯化钠固体质量为11.7 g.
(2)请补全以下配制溶液的主要步骤.
①将称量好的固体放入小烧杯中,加适量蒸馏水溶解;
②将所得溶液冷却至室温后,沿玻璃棒小心转入100mL容量瓶;
③用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液都转入容量瓶中;
④继续加蒸馏水至液面距刻度线1~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切;
⑤摇匀;
⑥装瓶,贴标签.
分析 (1)根据m=cVM计算需要氯化钠的质量;
(2)配制步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,根据配制一定物质的量浓度的溶液步骤解答.
解答 解:(1)需要氯化钠的质量为:2mol/L×0.1L×58.5g/mol=11.7g,
故答案为:11.7;
(2)②配制100mL溶液需要选用规格为100mL的容量瓶,所以将所得溶液冷却至室温后,沿玻璃棒小心转入100mL容量瓶;
③转移溶液后小于洗涤烧杯和玻璃杯,即用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液都转入容量瓶中;
④定容:继续加蒸馏水至液面距刻度线1~2 cm处,然后改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切,
故答案为:100 mL;洗涤烧杯和玻璃棒;溶液凹液面最低处与刻度线相切.
点评 本题考查了配制一定物质的量浓度的溶液方法,题目难度不大,明确配制步骤为解答关键,试题侧重基础知识的考查,有利于提高学生的化学实验能力.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案
相关题目
13.亚硫酸及其盐在工业上具有广泛的用途.下面来解释亚硫酸及其盐的有关性质的方程式正确的是( )
| A. | 亚硫酸水溶液的pH<7:H2SO3?2H++SO32- | |
| B. | 将亚硫酸滴入饱和Na2CO3溶液有气泡产生:2H++CO32-═H2O+CO2↑ | |
| C. | Na2SO3溶液能使红色石蕊变蓝:SO32-+H2O═HSO3-+OH- | |
| D. | Na2SO3溶液中加入足量的酸化Ba(NO3)2溶液出现白色沉淀:3SO32-+2NO3-+2H++3Ba2+═3BaSO4↓+2NO↑+H2O |
14.对下列实验操作和现象所作出的实验结论正确的是( )
| 实验操作和现象 | 实验结论 | |
| A | SO2通入Ba(NO3)2溶液中有白色沉淀生成 | 白色沉淀是BaSO3 |
| B | 向某待检液中滴加盐酸酸化的BaCl2溶液,生成白色沉淀 | 该待检液中可能不含有SO42- |
| C | 将FeCl3溶液分别滴入NaBr、NaI溶液中,再分别滴加CCl4,振荡,静置,下层分别呈无色和紫红色 | 氧化性:Fe3+>Br2>I2 |
| D | 向浓度均为0.1mol/L的KCl、KI混合液中滴加1~2滴0.01mol/LAgNO3溶液,产生黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
11.同质量的锌与稀硫酸反应,欲使反应速率最大,选择下列组合中的反应条件( )
①锌粒 ②芯片 ③锌粉 ④10%的稀硫酸 ⑤15%的稀硫酸 ⑥20%的稀硫酸
⑦加热 ⑧用水冷却 ⑨不断搅拌 ⑩迅速加入锌片后静置.
①锌粒 ②芯片 ③锌粉 ④10%的稀硫酸 ⑤15%的稀硫酸 ⑥20%的稀硫酸
⑦加热 ⑧用水冷却 ⑨不断搅拌 ⑩迅速加入锌片后静置.
| A. | ③⑥⑦⑩ | B. | ①④⑧⑩ | C. | ③⑥⑦⑨ | D. | ③⑤⑦⑨ |
18.氯气的水溶液称“氯水”,氯水中含有多种分子和离子,因此氯水有多重性质,下列有关新制氯水的说法中不正确的是( )
| A. | 新制氯水呈黄绿色,且有刺激性气味,说明氯水中含有Cl2 | |
| B. | 新制氯水滴在蓝色石蕊试纸上,试纸先变红色后褪色,可说明氯水中含有Cl2 | |
| C. | 向淀粉碘化钾溶液中加入氯水,溶液变成蓝色,说明Cl2可以与盐发生置换反应 | |
| D. | 新制氯水滴到Na2CO3溶液中,有气体产生,说明氯水中含有H+ |
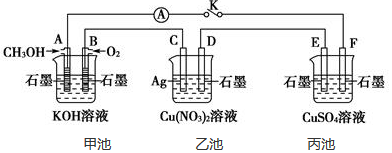
8.有关甲、乙、丙、丁四个图示的叙述正确的是( )

| A. | 甲中负极反应式为Ag++e-═Ag | |
| B. | 丙中H+向碳棒方向移动 | |
| C. | 乙中阳极反应式为2H++2e-═H2↑ | |
| D. | 丁中电解开始时阳极产生黄绿色气体 |
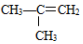 ②
②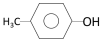 ;③
;③ ;④CH3CH2Cl;⑤CCl4;⑥CH3C≡CH;⑦HOCH2CH2OH;⑧CH3CH2OH;根据官能团的不同可分为( )
;④CH3CH2Cl;⑤CCl4;⑥CH3C≡CH;⑦HOCH2CH2OH;⑧CH3CH2OH;根据官能团的不同可分为( ) CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)
