题目内容
9. 平衡指的是两个相反方向的变化最后所处的运动状态;中学阶段涉及的平衡有气体可逆反应的平衡、酸碱电离平衡、水解平衡及沉淀-溶解平衡等.
平衡指的是两个相反方向的变化最后所处的运动状态;中学阶段涉及的平衡有气体可逆反应的平衡、酸碱电离平衡、水解平衡及沉淀-溶解平衡等.(1)现有容积为1L的恒温恒容密闭容器,向其中加入2mol A气体和2mol B气体后发生如下反应:A(g)+B(g)?C(g)△H=-a kJ•mol-1,20s后,反应达到平衡状态,生成1mol C气体,放出热量Q1kJ.回答下列问题.
①20s内B气体的平均化学反应速率为0.05mol•L-1•S-1.
②下列各项中能说明该反应已经达到平衡状态的有.
A.容器中气体的平均相对分子质量不随时间而变化
B.消耗1molA的同时消耗1molB
C.容器中气体的密度不随时间而变化
D.C的体积分数不随时间而变化
③保持容器温度和容积不变,若开始时向容器中加入2molC气体,反应达到平衡时,吸收热量Q2kJ,则Q1与Q2的相互关系正确的是AC(填字母).
(A)Q1+Q2=2a (B) Q1+2Q2<2a (C)Q1+2Q2>2a(D)Q1+Q2<a
④在原平衡基础上,保持容器温度和容积不变,向容器中再通入bmolA气体,重新达平衡后,B气体的转化率为60%,则b=0.7
(2)亚磷酸(H3PO3)是二元酸,与足量NaOH溶液反应生成Na2HPO3.25℃时H3PO3?H++H2PO3-的电离常数Ka=8.0×10-3 mol•L-1,该温度下NaH2PO3水解反应的平衡常数Kh=1.25×10-12mol•L-1mol•L-1.亚磷酸钠具有强还原性,可使碘水褪色.若向NaH2PO3溶液中加入少量I2,则溶液中$\frac{c({H}_{3}P{O}_{3})}{c({H}_{2}P{O}_{3}^{-})}$将变大 (填“变大”“变小”“不变”).
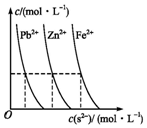
(3)如图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况.如果向三种沉淀中滴加盐酸,最先溶解的是FeS (填化学式).向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为PbS(填化学式)沉淀.
分析 (1)①根据反应速率v=$\frac{△c}{△t}$计算;
②根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
③加入2molA气体和2molB气体与加入2molC气体是在保持恒温、恒容情况下是等效平衡,则Q1+Q2=2a,据此判断;
④增加反应物的浓度平衡向正反应方向移动,由题意2molA气体和2molB气体生成1molC气体,根据三段式求得平衡常数K=1,依据温度不变,平衡常数不变进行解答;
(2)根据水解方程式H2PO3-+H2O H3PO3+OH-可知水解反应的平衡常数Kh=$\frac{c(OH{\;}^{-})c(H{\;}_{3}PO{\;}_{3})}{c(H{\;}_{2}PO{\;}_{3}{\;}^{-})}$=$\frac{c(H{\;}^{+})c(OH{\;}^{-})c(H{\;}_{3}PO{\;}_{3})}{c(H{\;}^{+})c(H{\;}_{2}PO{\;}_{3}{\;}^{-})}$=$\frac{K{\;}_{w}}{K{\;}_{a}}$;亚磷酸钠具有强还原性,可使碘水褪色.若向NaH2PO3溶液中加入少量I2,则亚磷酸根被碘氧化为磷酸,同时还有碘化氢生成,即氢离子浓度增大,氢氧根离子浓度减小,结合Kh=$\frac{c(OH{\;}^{-})c(H{\;}_{3}PO{\;}_{3})}{c(H{\;}_{2}PO{\;}_{3}{\;}^{-})}$判断;
H3PO3+OH-可知水解反应的平衡常数Kh=$\frac{c(OH{\;}^{-})c(H{\;}_{3}PO{\;}_{3})}{c(H{\;}_{2}PO{\;}_{3}{\;}^{-})}$=$\frac{c(H{\;}^{+})c(OH{\;}^{-})c(H{\;}_{3}PO{\;}_{3})}{c(H{\;}^{+})c(H{\;}_{2}PO{\;}_{3}{\;}^{-})}$=$\frac{K{\;}_{w}}{K{\;}_{a}}$;亚磷酸钠具有强还原性,可使碘水褪色.若向NaH2PO3溶液中加入少量I2,则亚磷酸根被碘氧化为磷酸,同时还有碘化氢生成,即氢离子浓度增大,氢氧根离子浓度减小,结合Kh=$\frac{c(OH{\;}^{-})c(H{\;}_{3}PO{\;}_{3})}{c(H{\;}_{2}PO{\;}_{3}{\;}^{-})}$判断;
(3)由图象可知Ksp(PbS)<Ksp(ZnS)<Ksp(FeS),以此解答.
解答 解:(1)①20s后,反应达到平衡状态,生成1mol C气体,则根据方程式可知消耗1molB,浓度是1mol/L,则20s内B气体的平均化学反应速率为v=$\frac{△c}{△t}$=$\frac{1mol/L}{20s}$=0.05mol•L-1•S-1,故答案为:0.05mol•L-1•S-1;
②在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态;
A.混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,因此容器中气体的平均相对分子质量不随时间而变化说明反应达到平衡状态,故A正确;
B.消耗1molA的同时消耗1molB均表示正反应速率,不能说明反应达到平衡状态,故B错误;
C.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,即密度始终不变,所以容器中气体的密度不随时间而变化不能说明反应达到平衡状态,故C错误;
D.C的体积分数不随时间而变化说明反应达到平衡状态,故D正确;
故选:AD;
③保持容器温度和容积不变,若开始时向容器中加入2molC气体,则相当于是2molA和2molB,所以平衡是等效的,因此反应达到平衡时,如果吸收热量Q2kJ,则Q1+Q2=2a,因此Q1+2Q2>2a,故选:AC.
④A(g)+B(g)?C(g)
起始量(mol) 2+b 2 0
转化量(mol) 1.2 1.2 1.2
平衡量(mol)0.8+b 0.8 1.2
温度不变平衡常数不变,则$\frac{1}{1×1}$=1=$\frac{1.2}{(0.8+b)×0.8}$
解得b=0.7,故答案为:0.7;
(2)根据水解方程式H2PO3-+H2O?H3PO3+OH-可知水解反应的平衡常数Kh=$\frac{c(OH{\;}^{-})c(H{\;}_{3}PO{\;}_{3})}{c(H{\;}_{2}PO{\;}_{3}{\;}^{-})}$=$\frac{c(H{\;}^{+})c(OH{\;}^{-})c(H{\;}_{3}PO{\;}_{3})}{c(H{\;}^{+})c(H{\;}_{2}PO{\;}_{3}{\;}^{-})}$=$\frac{K{\;}_{w}}{K{\;}_{a}}$=$\frac{10{\;}^{-14}}{8×10{\;}^{-3}}$=1.25×10-12mol•L-1.亚磷酸钠具有强还原性,可使碘水褪色.若向NaH2PO3溶液中加入少量I2,则亚磷酸根被碘氧化为磷酸,同时还有碘化氢生成,即氢离子浓度增大,氢氧根离子浓度减小,由于溶液中Kh=$\frac{c(OH{\;}^{-})c(H{\;}_{3}PO{\;}_{3})}{c(H{\;}_{2}PO{\;}_{3}{\;}^{-})}$,温度不变水解常数不变,又氢氧根离子浓度减小,所以$\frac{c(H{\;}_{3}PO{\;}_{3})}{c(H{\;}_{2}PO{\;}_{3}{\;}^{-})}$将变大,
故答案为:1.25×10-12mol•L-1;变大;
(3)由图象可知Ksp(PbS)<Ksp(ZnS)<Ksp(FeS),如果向三种沉淀中加盐酸,最先溶解的是FeS,根据溶解平衡可知,沉淀容易向生成更难溶的方向转化,向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为溶度积最小的PbS,
故答案为:FeS;PbS.
点评 本题主要考查平衡的有关知识以及难溶电解质的转化,掌握化学平衡常数的计算方法,以及化学平衡移动原理知识的灵活运用是解答的关键,题目难度较大,注意三段式的运用.

| A. | 氧气的气体摩尔体积是22.4L | B. | 硫酸的摩尔质量是98g | ||
| C. | CO2的相对分子质量是44g | D. | CO32-摩尔质量是60g/mol |
| A. | 工业上电解熔融的氯化钠可以制备钠 | |
| B. | 工业上用Cl2和石灰乳为原料制造漂白粉 | |
| C. | 工业上电解饱和氯化镁溶液可制取金属镁 | |
| D. | 工业上常用H2在Cl2中燃烧生成的氯化氢溶于水来制取盐酸 |
| 实验操作和现象 | 实验结论 | |
| A | SO2通入Ba(NO3)2溶液中有白色沉淀生成 | 白色沉淀是BaSO3 |
| B | 向某待检液中滴加盐酸酸化的BaCl2溶液,生成白色沉淀 | 该待检液中可能不含有SO42- |
| C | 将FeCl3溶液分别滴入NaBr、NaI溶液中,再分别滴加CCl4,振荡,静置,下层分别呈无色和紫红色 | 氧化性:Fe3+>Br2>I2 |
| D | 向浓度均为0.1mol/L的KCl、KI混合液中滴加1~2滴0.01mol/LAgNO3溶液,产生黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
| A. | O2 | B. | HCl | C. | CO2 | D. | NH3 |
| A. | 新制氯水呈黄绿色,且有刺激性气味,说明氯水中含有Cl2 | |
| B. | 新制氯水滴在蓝色石蕊试纸上,试纸先变红色后褪色,可说明氯水中含有Cl2 | |
| C. | 向淀粉碘化钾溶液中加入氯水,溶液变成蓝色,说明Cl2可以与盐发生置换反应 | |
| D. | 新制氯水滴到Na2CO3溶液中,有气体产生,说明氯水中含有H+ |
| A. | 某澄清透明溶液中:K+、Cu2+、NO3-、Cl- | |
| B. | 含0.1mol•L-1 Fe3+的溶液中:Na+、Mg2+、SO42-、Cl-、SCN- | |
| C. | 含0.1mol•L-1 CO32-的溶液中:OH-、Cl-、NH4+、Na+、H+ | |
| D. | 加入铝粉产生H2的溶液中:Al3+、Na+、SO42-、NO3- |