题目内容
2.选择下列实验方法分离物质,将分离方法的序号填在横线上.A.萃取分液法 B.蒸发溶剂结晶法 C.分液法 D.蒸馏法 E.过滤法F.升华法
(1)E分离饱和食盐水与沙子的混合物
(2)C分离水和四氯化碳的混合物
(3)D分离乙醇(沸点为78.3℃)和水(沸点为100℃)
(4)A从碘的水溶液里提取碘
(5)F分离碘单质和氯化钠的固体混合物
(6)B从氯化钠溶液中提取氯化钠固体.
分析 (1)沙子不溶于水,食盐溶于水;
(2)水和四氯化碳分层;
(3)乙醇与水互溶,但沸点不同;
(4)碘不易溶于水,易溶于有机溶剂;
(5)碘易升华,NaCl不能;
(6)氯化钠为可溶于水的物质,蒸发结晶可分离.
解答 解:(1)沙子不溶于水,食盐溶于水,则选择过滤法分离,故答案为:E;
(2)水和四氯化碳分层,则选择分液法分离,故答案为:C;
(3)乙醇与水互溶,但沸点不同,则选择蒸馏法分离,故答案为:D;
(4)碘不易溶于水,易溶于有机溶剂,则选择萃取分液法分离,故答案为:A;
(5)碘易升华,NaCl不能,则选择升华法分离,故答案为:F;
(6)氯化钠为可溶于水的物质,蒸发结晶可分离,故答案为:B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、混合物分离提纯为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
3. 常温下,用0.1000mol•L-1的盐酸滴定0.1000mol•L-1Na2CO3溶液25.00mL.用 pH传感器测得混合溶液的pH变化曲线如图,下列说法正确的是( )
常温下,用0.1000mol•L-1的盐酸滴定0.1000mol•L-1Na2CO3溶液25.00mL.用 pH传感器测得混合溶液的pH变化曲线如图,下列说法正确的是( )
 常温下,用0.1000mol•L-1的盐酸滴定0.1000mol•L-1Na2CO3溶液25.00mL.用 pH传感器测得混合溶液的pH变化曲线如图,下列说法正确的是( )
常温下,用0.1000mol•L-1的盐酸滴定0.1000mol•L-1Na2CO3溶液25.00mL.用 pH传感器测得混合溶液的pH变化曲线如图,下列说法正确的是( )| A. | c→d发生的主要离子反应:HCO3-+H+=H2O+CO2 | |
| B. | 在b点 时,c(CO32-)>c(HCO3)->c(OH-) | |
| C. | 在d点 时,c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) | |
| D. | 在e点 时c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
13.亚硫酸及其盐在工业上具有广泛的用途.下面来解释亚硫酸及其盐的有关性质的方程式正确的是( )
| A. | 亚硫酸水溶液的pH<7:H2SO3?2H++SO32- | |
| B. | 将亚硫酸滴入饱和Na2CO3溶液有气泡产生:2H++CO32-═H2O+CO2↑ | |
| C. | Na2SO3溶液能使红色石蕊变蓝:SO32-+H2O═HSO3-+OH- | |
| D. | Na2SO3溶液中加入足量的酸化Ba(NO3)2溶液出现白色沉淀:3SO32-+2NO3-+2H++3Ba2+═3BaSO4↓+2NO↑+H2O |
17.下列有关氯及其化合物的说法错误的是( )
| A. | 工业上电解熔融的氯化钠可以制备钠 | |
| B. | 工业上用Cl2和石灰乳为原料制造漂白粉 | |
| C. | 工业上电解饱和氯化镁溶液可制取金属镁 | |
| D. | 工业上常用H2在Cl2中燃烧生成的氯化氢溶于水来制取盐酸 |
7.下列溶液中物质的量浓度为1mol/L的是( )
| A. | 将40gNaOH固体溶解于1L水中 | |
| B. | 将22.4L氯化氢气体溶于水配成1L溶液 | |
| C. | 将1L 10 mol/L的浓盐酸与9L水混合 | |
| D. | 将10gNaOH溶解在少量水中,再加蒸馏水直到溶液体积为250mL |
14.对下列实验操作和现象所作出的实验结论正确的是( )
| 实验操作和现象 | 实验结论 | |
| A | SO2通入Ba(NO3)2溶液中有白色沉淀生成 | 白色沉淀是BaSO3 |
| B | 向某待检液中滴加盐酸酸化的BaCl2溶液,生成白色沉淀 | 该待检液中可能不含有SO42- |
| C | 将FeCl3溶液分别滴入NaBr、NaI溶液中,再分别滴加CCl4,振荡,静置,下层分别呈无色和紫红色 | 氧化性:Fe3+>Br2>I2 |
| D | 向浓度均为0.1mol/L的KCl、KI混合液中滴加1~2滴0.01mol/LAgNO3溶液,产生黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
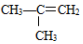 ②
②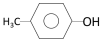 ;③
;③ ;④CH3CH2Cl;⑤CCl4;⑥CH3C≡CH;⑦HOCH2CH2OH;⑧CH3CH2OH;根据官能团的不同可分为( )
;④CH3CH2Cl;⑤CCl4;⑥CH3C≡CH;⑦HOCH2CH2OH;⑧CH3CH2OH;根据官能团的不同可分为( )