题目内容
8.下列反应的离子方程式书写正确的是( )| A. | 向碳酸氢钠溶液中滴加氢氧化钠溶液:OH-+HCO3-═CO32-+H2O | |
| B. | 溴化亚铁溶液中通入足量氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+2Cl- | |
| C. | 工业上将硫酸工业尾气SO2持续通入氨水中SO2+OH-═HSO3- | |
| D. | 向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO |
分析 A.反应生成碳酸钠和水;
B.亚铁离子、溴离子均被氧化;
C.一水合氨在离子反应中保留化学式;
D.反应生成HClO和碳酸氢钙.
解答 解:A.向碳酸氢钠溶液中滴加氢氧化钠溶液的离子反应为OH-+HCO3-═CO32-+H2O,故A正确;
B.溴化亚铁溶液中通入足量氯气的离子反应为2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故B错误;
C.工业上将硫酸工业尾气SO2持续通入氨水中SO2+NH3.H2O═HSO3-+NH4+,故C错误;
D.向次氯酸钙溶液通入过量CO2的离子反应为ClO-+H2O+CO2═HCO3-+HClO,故D错误;
故选A.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
11.下列变化中,属于物理变化的是( )
| A. | 熔融态的KCl导电 | |
| B. | 在Fe(OH)3胶体中加入MgSO4溶液析出红褐色沉淀 | |
| C. | 用加热方法分离沙子和NH4Cl晶体 | |
| D. | 蓝色CuSO4晶体,受热变为白色CuSO4粉末 |
12.2016年全国环境保护工作会议提出要“以改善环境质量为核心,实行最严格的环境保护制度,打好大气、水、土壤污染防治三大战役,确保2020年生态环境质量总体改善”.下列有关环境保护的说法中,正确的是( )
| A. | 纽扣银锌电池体型小,含有害物质少,用后可以随意丢弃 | |
| B. | 化石燃料完全燃烧不会造成大气污染 | |
| C. | “低碳”生活倡导节能减排,应禁止使用化石燃料,减少污水排放 | |
| D. | 将煤气化后再燃烧可减少大气污染 |
9.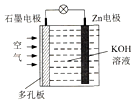 锌一空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时,下列说法正确的是( )
锌一空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时,下列说法正确的是( )
 锌一空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时,下列说法正确的是( )
锌一空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时,下列说法正确的是( )| A. | Zn电极是该电池的正极 | |
| B. | Zn电极的电极反应:Zn+H2O-2e-═ZnO+2H+ | |
| C. | OH-向石墨电极移动 | |
| D. | 氧气在石墨电极上发生还原反应 |
3.工业上利用反应2FeSO4+NaBH4+4NaOH=2Fe+2H2↑+Na[B(OH)4]+2Na2SO4制取纳米铁,下列说法不正确的是( )
| A. | NaBH4与盐酸不反应 | |
| B. | NaBH4的电子式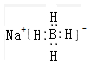 | |
| C. | 每生成1molFe,转移2mol电子 | |
| D. | 氧化产物与还原产物的物质的量之比为1:1 |
20.下列反应能产生Cl2的是( )
| A. | 加热稀盐酸和MnO2的混合物 | |
| B. | 在KMnO4中加入NaCl和浓H2SO4并加热 | |
| C. | KCl加硫酸并加KClO2再加热 | |
| D. | 浓盐酸中加入浓H2SO4并加热 |
17.下列离子组不能在溶液中大量共存并会同时产生沉淀和气体的是( )
| A. | Fe2+、NO3-、K+、Cl- | B. | K+、Al3+、HCO3-、Cl- | ||
| C. | H+、Ca2+、HCO3-、Cl- | D. | Ca2+、HCO3-、OH-、NO3- |
18.下列叙述正确的是( )
| A. | 通常,同周期元素的第一电离能ⅦA族的元素最大 | |
| B. | 在同一主族中,自上而下第一电离能逐渐减小 | |
| C. | 第ⅠA、ⅡA族元素的原子,其半径越大,第一电离能越大 | |
| D. | 主族元素的原子形成单原子离子时的化合价数都和它的族序数相等 |