题目内容
17.25℃时,水的电离达到平衡:H2O?H++OH--;△H>0,下列叙述正确的是( )| A. | 向水中加入稀氨水,平衡逆向移动,c(OH-)降低 | |
| B. | 向水中加入少量固体NaHSO4,c(H+)增大,KW不变 | |
| C. | 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)减小 | |
| D. | 将水加热,KW增大,pH不变 |
分析 水电离生成氢离子、氢氧根离子,所以加入能电离出氢离子或氢氧根离子的物质抑制水电离,加入和氢离子或氢氧根离子反应的物质能促进水电离,温度不变,离子积常数不变,据此分析解答.
解答 解:A.一水合氨电离出OH-而导致溶液中c(OH-)增大,从而抑制水电离,平衡逆向进行,氢氧根离子浓度增大,故A错误;
B.向水中加入硫酸氢钠固体,硫酸氢钠电离出氢离子导致溶液中c(H+)增大,温度不变Kw不变,故B正确;
C.向水中加入少量固体CH3COONa,CH3COONa和水发生水解反应生成NaOH,盐类水解促进水电离,平衡正向进行,氢氧根离子浓度增大,氢离子浓度减小,故C错误;
D.水的电离是吸热过程,升高温度促进水电离,则Kw增大,pH减小,故D错误;
故选B.
点评 本题考查离子积常数、水的电离,明确氢离子或氢氧根离子抑制水电离、弱离子水解促进水电离即可解答,注意离子积常数与溶液酸碱性无关,只与温度有关,题目较简单.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
7.下列有关实验的描述正确的是( )
| 选项 | 操作 | 实验目的 |
| A | 沿玻璃棒将蒸馏水缓慢倒入盛有浓硫酸的烧杯中,边加边搅拌 | 稀释浓硫酸 |
| B | 测定相同浓度的Na2SO4和Na2SiO3溶液的pH值 | 比较硫和硅的非金属性强弱 |
| C | 将铁的氧化物溶于过量稀盐酸中,再滴加几滴紫红色KMnO4溶液 | 判断某铁的氧化物是否含有Fe2+ |
| D | 用装有双氧水的碱式滴定管,采用淀粉溶液作为指示剂,滴定NaCl和NaI混合溶液 | 测定NaI的含量 |
| A. | A | B. | B | C. | C | D. | D |
8.下列反应的离子方程式书写正确的是( )
| A. | MgO溶于稀盐酸中:O2-+2H+═H2O | |
| B. | 碳酸钙中滴加稀盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | 实验室用MnO2反应制Cl2:MnO2+2H++2Cl-═Cl2↑+Mn2++H2O | |
| D. | 向氢氧化钠溶液中通入过量二氧化碳:OH-+CO2=HCO3- |
12.将下列选项中的物质加人(或通入)氢硫酸溶液中,可使反应后溶液酸性最终增强的是( )
| A. | 氯气 | B. | 氢氧化钠 | C. | 硫酸钠 | D. | 二氧化硫 |
9.现有如下反应热信息
下列说法正确的是( )
| 热化学方程式 | △H |
| 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(1) | -2600 kJ•mol-1 |
| 2C6H6(g)+15O2(g)═12CO2(g)+6H2O(1) | -6590 kJ•mol-1 |
| 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(g) | -a kJ•mol-1 |
| 2C6H6(1)+15O2(g)═12CO2(g)+6H2O(1) | -b kJ•mol-1 |
| A. | a>2600 | |
| B. | b>6590 | |
| C. | 相同条件下,等质量的C2H2(g)与C6H6(g)完全燃烧,C2H2(g)放热更多 | |
| D. | C2H2(g)三聚生成C6H6(g)的过程属于吸热反应 |
13.下列叙述正确的是( )
| A. | 1molH2O的质量为18g/mol | B. | CH4的摩尔质量为16g | ||
| C. | 1mol任何气体体积均为22.4L | D. | 0.5molSO2分子的质量为32g |
14.某一元弱酸HA的相对分子质量为M.在t℃时,将ag HA完全溶解于水中,得V mL饱和溶液,测得该溶液的密度为ρ g/cm3,其中溶液pH=b.下列叙述中,错误的是( )
| A. | t℃时,HA的Ka=10-2b/1000a/MV | |
| B. | 物质的量浓度:c(HA)=1000a/MV mol•L-1 | |
| C. | t℃时,HA的溶解度:S=100a/ρV g | |
| D. | HA的质量分数:ω(HA)=(a/ρV)×100% |
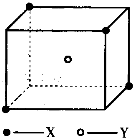 某晶体的晶胞结构如图所示.X(•)位于立方体顶点,Y(○)位于立方体中心.试分析:
某晶体的晶胞结构如图所示.X(•)位于立方体顶点,Y(○)位于立方体中心.试分析: