题目内容
13.下列叙述正确的是( )| A. | 1molH2O的质量为18g/mol | B. | CH4的摩尔质量为16g | ||
| C. | 1mol任何气体体积均为22.4L | D. | 0.5molSO2分子的质量为32g |
分析 A.质量的单位是g,摩尔质量的单位是g/mol;
B.摩尔质量的单位是g/mol,在数值上等于其相对分子质量;
C.气体摩尔体积受温度和压强影响;
D.根据m=nM计算质量.
解答 解:A.质量的单位是g,摩尔质量的单位是g/mol,1mol水的质量是18g,故A错误;
B.摩尔质量的单位是g/mol,在数值上等于其相对分子质量,甲烷的摩尔质量是16g/mol,故B错误;
C.气体摩尔体积受温度和压强影响,未指明温度和压强,无法计算气体体积,故C错误;
D.m=nM=0.5mol×64g/mol=32g,故D正确;
故选D.
点评 本题考查物质的量有关计算,为高频考点,侧重考查基本概念、基本计算,明确各个物理量单位、气体摩尔体积适用范围及适用条件是解本题关键,题目难度不大.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
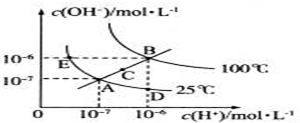
17.25℃时,水的电离达到平衡:H2O?H++OH--;△H>0,下列叙述正确的是( )
| A. | 向水中加入稀氨水,平衡逆向移动,c(OH-)降低 | |
| B. | 向水中加入少量固体NaHSO4,c(H+)增大,KW不变 | |
| C. | 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)减小 | |
| D. | 将水加热,KW增大,pH不变 |
1.下列与实验相关的叙述正确的是( )
| A. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 配制溶液时,若加水超过容量瓶刻度线,应用胶头滴管将多余溶液吸出 | |
| C. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 | |
| D. | 用分液的方法分离汽油和氯化钠溶液 |
8.下列各组离子在水溶液中能大量共存的是( )
| A. | NH4+、Na+、Cl-、OH- | B. | Fe3+、H+、Cl-、CH3COO- | ||
| C. | Fe3+、SCN-、K+、Cl- | D. | H+、Fe2+、SO42-、Cl- |
18. 氮族元素氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的是( )
氮族元素氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的是( )
 氮族元素氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的是( )
氮族元素氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的是( )| A. | 相对分子质量 | B. | 稳定性 | C. | 沸点 | D. | R-H键长 |
2.《本草纲目拾遗》中在药物名“鼻冲水”条目下写到:贮以玻璃瓶,紧塞其口,勿使泄气,则药力不减.气甚辛烈,触人脑,非有病不可嗅;在“刀创水”条目下写到:治金创,以此水涂伤口,即敛合如故.这里所说的“鼻冲水”、“刀创水”分别指的是( )
| A. | 氢氟酸、食盐水 | B. | 氨水、碘酒 | C. | 石灰水、硝酸 | D. | 稀硫酸、食醋 |
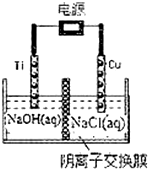 硝酸是一种重要的化工原料,工业上一般以氨气为原料来制备硝酸.请回答:
硝酸是一种重要的化工原料,工业上一般以氨气为原料来制备硝酸.请回答: