题目内容
9.现有如下反应热信息| 热化学方程式 | △H |
| 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(1) | -2600 kJ•mol-1 |
| 2C6H6(g)+15O2(g)═12CO2(g)+6H2O(1) | -6590 kJ•mol-1 |
| 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(g) | -a kJ•mol-1 |
| 2C6H6(1)+15O2(g)═12CO2(g)+6H2O(1) | -b kJ•mol-1 |
| A. | a>2600 | |
| B. | b>6590 | |
| C. | 相同条件下,等质量的C2H2(g)与C6H6(g)完全燃烧,C2H2(g)放热更多 | |
| D. | C2H2(g)三聚生成C6H6(g)的过程属于吸热反应 |
分析 A、液态水变成气态水要吸热,所以生成液态水放出热量大于2600 kJ;
B、气体苯的能量高于液态苯,所以气态苯放出的热量多;
C、相同条件下,等质量的C2H2(g)与C6H6(g),6mol的C2H2(g)和2molC6H6(g)的质量相等,放出热量分别为:3×2600 kJ和2×6590kJ;
D、由盖斯定律:①2C2H2(g)+5O2(g)═4CO2(g)+2H2O(1)△H=-2600 kJ•mol-1;②2C6H6(g)+15O2(g)═12CO2(g)+6H2O(1)△H=-6590 kJ•mol-1,3C2H2(g)=C6H6(g)△H=$\frac{3×①-②}{2}$.
解答 解:A、液态水变成气态水要吸热,所以生成液态水放出热量小于2600 kJ,则a>2600,故A正确;
B、气体苯的能量高于液态苯,所以气态苯放出的热量多,所以b<6590,故B错误;
C、相同条件下,等质量的C2H2(g)与C6H6(g),6mol的C2H2(g)和2molC6H6(g)的质量相等,放出热量分别为:3×2600 kJ和2×6590kJ,后者多,所以相同条件下,等质量的C2H2(g)与C6H6(g)完全燃烧,C2H2(g)放热更少,故C错误;
D、由盖斯定律:①2C2H2(g)+5O2(g)═4CO2(g)+2H2O(1)△H=-2600 kJ•mol-1;②2C6H6(g)+15O2(g)═12CO2(g)+6H2O(1)△H=-6590 kJ•mol-1,3C2H2(g)=C6H6(g)△H=$\frac{3×①-②}{2}$=$\frac{-3×2600-(-6590)}{2}$=-605kJ•mol-1,所以C2H2(g)三聚生成C6H6(g)的过程属于放热反应,故D错误;
故选A.
点评 本题考查化学反应与能量的变为,为高考常见题型和高频考点,注意把握物质的状态与能量的变化关系,结合盖斯定律解答该题,难度不大.

 全优点练单元计划系列答案
全优点练单元计划系列答案| A. | 配制FeSO4溶液,应先将盐溶解在稀硫酸中,再加水稀释到所需浓度,并加入少量铁屑 | |
| B. | 切割白磷时,必须用镊子夹取,置于桌面上的玻璃片上,小心用刀切割 | |
| C. | 向淀粉溶液中加入稀硫酸,水浴加热一段时间.要证明淀粉已水解,取样后加入银氨溶液,水浴加热,观察是否有银镜生成 | |
| D. | 配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
| A. | HCl气体溶于水 | B. | 碘单质升华 | ||
| C. | 氯化镁受热熔化 | D. | 二氧化硅受热熔化 |
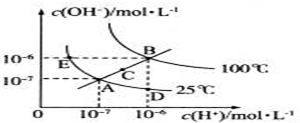
| A. | 向水中加入稀氨水,平衡逆向移动,c(OH-)降低 | |
| B. | 向水中加入少量固体NaHSO4,c(H+)增大,KW不变 | |
| C. | 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)减小 | |
| D. | 将水加热,KW增大,pH不变 |
| A. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 配制溶液时,若加水超过容量瓶刻度线,应用胶头滴管将多余溶液吸出 | |
| C. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 | |
| D. | 用分液的方法分离汽油和氯化钠溶液 |
| A. | NH4+、Na+、Cl-、OH- | B. | Fe3+、H+、Cl-、CH3COO- | ||
| C. | Fe3+、SCN-、K+、Cl- | D. | H+、Fe2+、SO42-、Cl- |
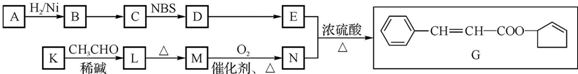
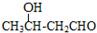
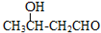 $\stackrel{△}{→}$CH3CH=CHCHO+H2O
$\stackrel{△}{→}$CH3CH=CHCHO+H2O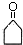 .
. .
.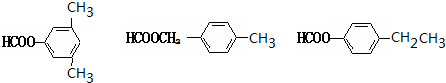 (其中两种).
(其中两种).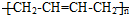 ).请设计合成路线(其他无机原料任选)并用如下方式表示:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物HOCH2CH2CH2CH3$→_{△}^{浓H_{2}SO_{4}}$CH2=CHCH2CH3$\stackrel{NBS}{→}$CH2=CHCHBrCH3$→_{△}^{氢氧化钠醇溶液}$CH2=CHCH=CH2$\stackrel{催化剂}{→}$
).请设计合成路线(其他无机原料任选)并用如下方式表示:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物HOCH2CH2CH2CH3$→_{△}^{浓H_{2}SO_{4}}$CH2=CHCH2CH3$\stackrel{NBS}{→}$CH2=CHCHBrCH3$→_{△}^{氢氧化钠醇溶液}$CH2=CHCH=CH2$\stackrel{催化剂}{→}$