题目内容
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药 上也可用于治疗消化性溃荡出血.工业上利用废铁屑(含少量铝)生产碱式硫酸铁的工艺流 程如下:

请回答下列问题:
(1)碱式硫酸铁能够净水的原因是 .
(2)已知,常温下部分阳离子以氢氧化物形式完全沉淀时溶液的PH如右表.假设沉淀完全时溶解时溶液中金属离子的浓度为1.0×10-5mol/L,估算.Ksp[Fe(OH)2]= 生产碱式硫酸铁的过程中,加入少量NaHCO3调溶液pH=6的目的是 .
(3)反应II的离子方程式是 ,在实际生产中,常同时通入O2以减少反应II中NaNO2的用量.若实际生产中需要节约1.38t的NaNO2用量,则应通入标准 状况下的02 m3
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-某同学根据提供的试剂设计实验检验所得产品中不含 Fe2+,含有SO2-4可供选择的试剂如下:
A.新制氯水B.0.1mol/LKSCN 溶液C.10%NaOH 溶液
D.20% HNO3 溶液 E.0.05mol/L 酸性 KMnO4 溶液 F.0.1mol/L BaCl2 溶液
请你帮助该同学完成实验,将相关项目填入下表:

请回答下列问题:
(1)碱式硫酸铁能够净水的原因是
| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀时的pH | 7.0 | 1.9 | 3.4 |
| 沉淀完全时的pH | 9.0 | 3.2 | 4.7 |
(3)反应II的离子方程式是
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-某同学根据提供的试剂设计实验检验所得产品中不含 Fe2+,含有SO2-4可供选择的试剂如下:
A.新制氯水B.0.1mol/LKSCN 溶液C.10%NaOH 溶液
D.20% HNO3 溶液 E.0.05mol/L 酸性 KMnO4 溶液 F.0.1mol/L BaCl2 溶液
请你帮助该同学完成实验,将相关项目填入下表:
| 实验操作 | 现象 | 结论 |
| 取适量产品于洁净烧杯中,加入适量蒸馏 | 得黄棕色溶液 | |
| 水,充分搅拌,静置,滤去沉淀. | ||
| 溶液中不含Fe2+ | ||
| 溶液中含有SO42- |
考点:制备实验方案的设计,化学方程式的有关计算,性质实验方案的设计
专题:实验设计题
分析:(1)依据氢氧化铁胶体具有吸附悬浮杂质的作用分析净水原理;
(2)沉淀完全时溶解时溶液中金属离子的浓度为1.0×10-5mol/L,氢氧化亚铁完全沉淀的PH=9,结合离子积常数和溶度积常数计算得到;加入少量NaHCO3调溶液pH=6的目的是把溶液中的铝离子全部沉淀;
(3)流程分析反应Ⅱ是亚硝酸钠在酸溶液中氧化亚铁离子为铁离子,依据氧化还原反应电子守恒和电荷守恒,原子守恒配平写出;依据氧化还原反应电子守恒计算;
(4)证明不含有亚铁离子需要选择高锰酸钾溶液褪色与否进行实验验证,证明含有硫酸根离子的实验是依据硫酸根离子检验方法选择试剂检验,根据提供的试剂需要选择氯化钡溶液和稀硝酸;
(2)沉淀完全时溶解时溶液中金属离子的浓度为1.0×10-5mol/L,氢氧化亚铁完全沉淀的PH=9,结合离子积常数和溶度积常数计算得到;加入少量NaHCO3调溶液pH=6的目的是把溶液中的铝离子全部沉淀;
(3)流程分析反应Ⅱ是亚硝酸钠在酸溶液中氧化亚铁离子为铁离子,依据氧化还原反应电子守恒和电荷守恒,原子守恒配平写出;依据氧化还原反应电子守恒计算;
(4)证明不含有亚铁离子需要选择高锰酸钾溶液褪色与否进行实验验证,证明含有硫酸根离子的实验是依据硫酸根离子检验方法选择试剂检验,根据提供的试剂需要选择氯化钡溶液和稀硝酸;
解答:
解:(1)碱式硫酸铁能够净水的原因是,碱式硫酸铁在溶液中铁离子水解生成了具有较强吸附能量的氢氧化铁胶体,吸附悬浮在水中杂质的起到净水作用;
故答案为:能水解生成具有吸附能力较强的胶体;
(2)沉淀完全时溶解时溶液中金属离子的浓度为1.0×10-5mol/L,氢氧化亚铁完全沉淀的PH=9,c(H+)=10-9mol/L,c(OH-)=10-5mol/L,依据溶度积常数计算方法得到Ksp=c(Fe2+)c2(OH-)=1.0×10-5mol/L×(10-5mol/L)2=1×10-15(mol/L)3;加入少量NaHCO3调溶液pH=6的目的是把溶液中的铝离子全部沉淀;
故答案为:1×10-15(mol/L)3;调节溶液PH促进Al3+水解转化为沉淀除去;
(3)分析反应Ⅱ是亚硝酸钠在酸溶液中氧化亚铁离子为铁离子,依据氧化还原反应电子守恒和电荷守恒,原子守恒写出的离子方程式为:Fe2++2H++NO2-=Fe3++NO↑+H2O;在实际生产中,常同时通入O2以减少反应II中NaNO2的用量.若实际生产中需要节约1.38t的NaNO2用量,物质的量=
=2×104mol,转移电子2×104mol,依据电子守恒计算:
4NaNO2~4NO~4e-~O2~4e-
4 1
2×104mol n(O2)
n(O2)=5×103mol
V(O2)=5×103mol×22.4mol/L=1.12×105L=112m3;
则应通入标准 状况下的02 的体积为112m3;
故答案为:Fe2++2H++NO2-=Fe3++NO↑+H2O;112;
(4)根据提供的试剂设计实验检验所得产品中不含 Fe2+,含有SO42-,实验证明不含有亚铁离子需要选择高锰酸钾溶液褪色与否进行实验验证,证明含有硫酸根离子的实验是依据硫酸根离子检验方法选择试剂检验,具体步骤为:取适量产品于洁净烧杯中,加入适量蒸馏水,充分搅拌,静置,滤去沉淀,得黄棕色溶液,取少量溶液于试管中,滴加0.05mol/l的酸性高锰酸钾溶液,溶液不褪色证明溶液中不含Fe2+,取少量溶液于试管中,滴加0.1mol/L的BaCl2 溶液,再加入20% HNO3 溶液,白色沉淀,溶液中含有SO42-;
故答案为:取少量溶液于试管中,滴加0.05mol/l的酸性高锰酸钾溶液,溶液不褪色证明溶液中不含Fe2+,取少量溶液于试管中,滴加0.1mol/L的BaCl2 溶液,再加入20% HNO3 溶液,白色沉淀,溶液中含有SO42-;
故答案为:能水解生成具有吸附能力较强的胶体;
(2)沉淀完全时溶解时溶液中金属离子的浓度为1.0×10-5mol/L,氢氧化亚铁完全沉淀的PH=9,c(H+)=10-9mol/L,c(OH-)=10-5mol/L,依据溶度积常数计算方法得到Ksp=c(Fe2+)c2(OH-)=1.0×10-5mol/L×(10-5mol/L)2=1×10-15(mol/L)3;加入少量NaHCO3调溶液pH=6的目的是把溶液中的铝离子全部沉淀;
故答案为:1×10-15(mol/L)3;调节溶液PH促进Al3+水解转化为沉淀除去;
(3)分析反应Ⅱ是亚硝酸钠在酸溶液中氧化亚铁离子为铁离子,依据氧化还原反应电子守恒和电荷守恒,原子守恒写出的离子方程式为:Fe2++2H++NO2-=Fe3++NO↑+H2O;在实际生产中,常同时通入O2以减少反应II中NaNO2的用量.若实际生产中需要节约1.38t的NaNO2用量,物质的量=
| 1.38t |
| 69g/mol |
4NaNO2~4NO~4e-~O2~4e-
4 1
2×104mol n(O2)
n(O2)=5×103mol
V(O2)=5×103mol×22.4mol/L=1.12×105L=112m3;
则应通入标准 状况下的02 的体积为112m3;
故答案为:Fe2++2H++NO2-=Fe3++NO↑+H2O;112;
(4)根据提供的试剂设计实验检验所得产品中不含 Fe2+,含有SO42-,实验证明不含有亚铁离子需要选择高锰酸钾溶液褪色与否进行实验验证,证明含有硫酸根离子的实验是依据硫酸根离子检验方法选择试剂检验,具体步骤为:取适量产品于洁净烧杯中,加入适量蒸馏水,充分搅拌,静置,滤去沉淀,得黄棕色溶液,取少量溶液于试管中,滴加0.05mol/l的酸性高锰酸钾溶液,溶液不褪色证明溶液中不含Fe2+,取少量溶液于试管中,滴加0.1mol/L的BaCl2 溶液,再加入20% HNO3 溶液,白色沉淀,溶液中含有SO42-;
故答案为:取少量溶液于试管中,滴加0.05mol/l的酸性高锰酸钾溶液,溶液不褪色证明溶液中不含Fe2+,取少量溶液于试管中,滴加0.1mol/L的BaCl2 溶液,再加入20% HNO3 溶液,白色沉淀,溶液中含有SO42-;
点评:本题考查了实验制备物质的分析应用,离子检验方法和设计,化学方程式,氧化还原反应电子守恒的计算式解题关键,题目难度中等.

练习册系列答案
相关题目
下列实验方法正确的是( )
| A、配制一定物质的量浓度的溶液时,若加水超过容量瓶的刻度线,用胶头滴管将多余液体吸出即可 |
| B、区别Na2CO3和NaHCO3时,可将它们分别和Ca(OH)2溶液混合,看有无沉淀产生 |
| C、区别FeCl3溶液和Fe(OH)3胶体时,可将它们分别用一束光照射,看有无丁达尔效应出现 |
| D、检验某溶液中是否含有NH4+离子时,可加入适量的氢氧化钠溶液并加热,再用湿润的蓝色石蕊试纸检验产生的气体即可 |
下列离子方程式中正确的是( )
A、在硫酸铜溶液中加入过量氢氧化钡溶液 Ba2++SO
| ||||
B、二氧化碳通入碳酸钠溶液中 CO2+CO
| ||||
| C、金属钠投入水中 Na+2H2O=Na++2OH-+H2↑ | ||||
| D、氯气通入冷的氢氧化钠溶液中 2Cl2+2OH-=3Cl-+ClO-+H2O |
实验是化学研究的基础,下列实验操作或装置中正确的是( )
A、 向试管中滴加液体 |
B、 碳酸氢钠受热分解 |
C、 除去CO气体中的CO2气体 |
D、 过滤 |


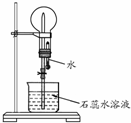 A是一种白色晶体,受热分解能生成B、C两种无色气体,C的水溶液与硝酸银溶液反应产生白色沉淀.A与浓NaOH溶液共热,放出无色气体B.若在圆底烧瓶中分别收集干燥的气体B和C,然后将收集满气体的烧瓶按如图所示装置组装,挤压滴管的胶头时,可以分别得到蓝色喷泉和红色喷泉.
A是一种白色晶体,受热分解能生成B、C两种无色气体,C的水溶液与硝酸银溶液反应产生白色沉淀.A与浓NaOH溶液共热,放出无色气体B.若在圆底烧瓶中分别收集干燥的气体B和C,然后将收集满气体的烧瓶按如图所示装置组装,挤压滴管的胶头时,可以分别得到蓝色喷泉和红色喷泉.