题目内容
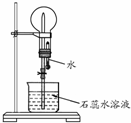 A是一种白色晶体,受热分解能生成B、C两种无色气体,C的水溶液与硝酸银溶液反应产生白色沉淀.A与浓NaOH溶液共热,放出无色气体B.若在圆底烧瓶中分别收集干燥的气体B和C,然后将收集满气体的烧瓶按如图所示装置组装,挤压滴管的胶头时,可以分别得到蓝色喷泉和红色喷泉.
A是一种白色晶体,受热分解能生成B、C两种无色气体,C的水溶液与硝酸银溶液反应产生白色沉淀.A与浓NaOH溶液共热,放出无色气体B.若在圆底烧瓶中分别收集干燥的气体B和C,然后将收集满气体的烧瓶按如图所示装置组装,挤压滴管的胶头时,可以分别得到蓝色喷泉和红色喷泉.请填写下列空白:
(1)A的化学式是
(2)收集气体B的方法是
(3)B与C两气体相遇时,可观察到的现象是
(4)A与浓NaOH溶液共热时,发生反应的离子方程式是
考点:几组未知物的检验
专题:物质检验鉴别题,元素及其化合物
分析:在圆底烧瓶中分别收集干燥的气体B和C,可以与水反应进行喷泉实验,说明B和C极易溶于水,常见的气体为NH3、HCl,再根据C的水溶液与硝酸银溶液反应产生白色沉淀可知C为HCl,则B为NH3,氨气与氯化氢反应生成A.NH4C1,据此进行解答.
解答:
解:(1)气体B和C可以与水反应进行喷泉实验,说明B和C极易溶于水,常见的气体为NH3、HCl;C的水溶液与硝酸银溶液反应生成白色沉淀,则C为HCl,B为NH3,氯化氢与氨气反应生成的A为NH4C1,
故答案为:NH4C1;
(2)B为氨气,氨气极易溶于水,只能使用排空气法收集,氨气密度小于空气,应该使用向下排空气法收集,故答案为:向下排空气法;
(3)氨气与氯化氢相遇会生成白色的烟,故答案为:有白色烟生成;
(4)氯化铵与氢氧化钠在加热条件下反应生成氯化钠和氨气,反应的离子方程式为NH4++OH-
NH3↑+H2O,故答案为:NH4++OH-
NH3↑+H2O.
故答案为:NH4C1;
(2)B为氨气,氨气极易溶于水,只能使用排空气法收集,氨气密度小于空气,应该使用向下排空气法收集,故答案为:向下排空气法;
(3)氨气与氯化氢相遇会生成白色的烟,故答案为:有白色烟生成;
(4)氯化铵与氢氧化钠在加热条件下反应生成氯化钠和氨气,反应的离子方程式为NH4++OH-
| ||
| ||
点评:本题考查了未知物的推断、铵盐的性质及喷泉实验等知识,题目难度中等,注意掌握常见未知物的检验方法,本题中B、C分别与水能完成喷泉实验是解题关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
反应:Zn+H2SO4=ZnSO4+H2↑,属于( )
| A、化合反应 | B、分解反应 |
| C、置换反应 | D、复分解反应 |
原电池的主要功能是将化学能转化为( )
| A、热能 | B、光能 | C、核能 | D、电能 |
下列有关实验操作或方案错误的是( )
| A、用水鉴别苯、四氯化碳、酒精三种液体 |
| B、加入足量铁屑除去FeCl2溶液中的少量FeCl3 |
| C、用激光笔照射稀豆浆,检验其是否为胶体 |
| D、配制一定物质的量浓度溶液时,容量瓶用蒸馏水洗涤后再用待装溶液润洗 |
 观察如图所示的装置,回答下列问题:
观察如图所示的装置,回答下列问题:
 已知A元素位于元素周期表第三周期,其原子最外层电子数是最内层电子数的一半.甲、乙、丙、丁四种物质均含A元素,其中乙为白色固体,它们之间有如图所示转化关系.
已知A元素位于元素周期表第三周期,其原子最外层电子数是最内层电子数的一半.甲、乙、丙、丁四种物质均含A元素,其中乙为白色固体,它们之间有如图所示转化关系.