题目内容
A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,C的非金属性最强,A、D同主族隔周期,E元素原子最外层的p亚层电子数是s亚层电子数的一半.A、B能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1.根据以上信息回答下列问题:
(1)甲、乙两分子中含有非极性共价键的物质的电子式是 ,C元素在周期表中的位置是 .
(2)C和D的离子中,半径较小的是 (填离子符号).
(3)将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是
(4)C、D、E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心.该化合物的化学式是 .
(5)如图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化.下列说法正确的是
A.γ-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
B.α-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
C.若δ-Fe晶胞边长为acm,α-Fe晶胞边长为bcm,则两种晶体密度比为2b3:a3
D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同

(1)甲、乙两分子中含有非极性共价键的物质的电子式是
(2)C和D的离子中,半径较小的是
(3)将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是
(4)C、D、E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心.该化合物的化学式是

(5)如图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化.下列说法正确的是
A.γ-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
B.α-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
C.若δ-Fe晶胞边长为acm,α-Fe晶胞边长为bcm,则两种晶体密度比为2b3:a3
D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同

考点:晶胞的计算,位置结构性质的相互关系应用,极性键和非极性键
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:A、B、C、D、E都是短周期元素,原子序数依次增大,A、D同主族隔周期,A的原子序数小于D,则A为H元素,则D为Na元素;B、C同周期,且B、C的原子序数小于D,则B和C位于第二周期元素,C的非金属性最强,则C是F元素,A、B能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1,则B是O元素,甲是H2O,乙是H2O2,E元素原子最外层的p亚层电子数是s亚层电子数的一半,且原子序数大于11,所以E是Al元素,结合原子结构、物质性质分析解答.
解答:
解:A、B、C、D、E都是短周期元素,原子序数依次增大,A、D同主族隔周期,A的原子序数小于D,则A为H元素,则D为Na元素;B、C同周期,且B、C的原子序数小于D,则B和C位于第二周期元素,C的非金属性最强,则C是F元素,A、B能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1,则B是O元素,甲是H2O,乙是H2O2,E元素原子最外层的p亚层电子数是s亚层电子数的一半,且原子序数大于11,所以E是Al元素,
(1)甲、乙两分子中含有非极性共价键的物质是H2O2,H2O2的电子式是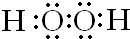 ,C元素是O元素,O元素在周期表中的位置是第二周期第VIIA族,
,C元素是O元素,O元素在周期表中的位置是第二周期第VIIA族,
故答案为: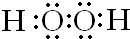 ;第二周期、第ⅦA族;
;第二周期、第ⅦA族;
(2)C和D的离子分别是F-和Na+,电子层结构相同的离子中,离子半径随着原子序数的增大而减小,所以半径较小的是Na+,故答案为:Na+;
(3)钠和水反应生成NaOH和氢气,Al和NaOH溶液反应生成偏铝酸钠和水,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(4)F、Na、Al可组成离子化合物,阳离子Na+(用○表示)位于正方体的棱的中点和正方体内部;阴离子AlF6x-(用●表示)位于该正方体的顶点和面心.该化合物的化学式是
阴离子个数=8×
+6×
=4,Na+个数=12×
+8+1=12,阴阳离子个数比=4:12=1:3,化合物中阴阳离子所带电荷相等,所以x=3,则其化学式为:Na3AlF6,故答案为:Na3AlF6;
(5)A.γ-Fe晶体中与每个铁原子距离相等且最近的铁原子个数=3×8×
=12,故错误;
B.α-Fe晶体中与每个铁原子距离相等且最近的铁原子是相邻顶点上铁原子,铁原子个数=2×3=6,故正确;
C.若δ-Fe晶胞边长为acm,α-Fe晶胞边长为bcm,则两种晶体中铁原子个数之比=(1+8×
):(8×
)=2:1,密度比=
:
=2b3:a3,故正确;
D.将铁加热到1500℃分别急速冷却和缓慢冷却,温度不同,得到的晶体类型不相同,故错误;
故选B C.
(1)甲、乙两分子中含有非极性共价键的物质是H2O2,H2O2的电子式是
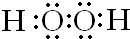 ,C元素是O元素,O元素在周期表中的位置是第二周期第VIIA族,
,C元素是O元素,O元素在周期表中的位置是第二周期第VIIA族,故答案为:
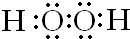 ;第二周期、第ⅦA族;
;第二周期、第ⅦA族;(2)C和D的离子分别是F-和Na+,电子层结构相同的离子中,离子半径随着原子序数的增大而减小,所以半径较小的是Na+,故答案为:Na+;
(3)钠和水反应生成NaOH和氢气,Al和NaOH溶液反应生成偏铝酸钠和水,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(4)F、Na、Al可组成离子化合物,阳离子Na+(用○表示)位于正方体的棱的中点和正方体内部;阴离子AlF6x-(用●表示)位于该正方体的顶点和面心.该化合物的化学式是
阴离子个数=8×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
(5)A.γ-Fe晶体中与每个铁原子距离相等且最近的铁原子个数=3×8×
| 1 |
| 2 |
B.α-Fe晶体中与每个铁原子距离相等且最近的铁原子是相邻顶点上铁原子,铁原子个数=2×3=6,故正确;
C.若δ-Fe晶胞边长为acm,α-Fe晶胞边长为bcm,则两种晶体中铁原子个数之比=(1+8×
| 1 |
| 8 |
| 1 |
| 8 |
| ||
| a3 |
| ||
| b3 |
D.将铁加热到1500℃分别急速冷却和缓慢冷却,温度不同,得到的晶体类型不相同,故错误;
故选B C.
点评:本题考查了物质结构和性质,涉及晶胞的计算、电子式的书写、物质间的反应等知识点,根据元素周期表及原子结构判断元素,再结合均摊法、物质的性质等知识点来分析解答,难点是晶胞密度的计算,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列反应既是氧化还原反应,又是吸热反应的是( )
| A、Ba(OH)2?8H2O与NH4Cl的反应 |
| B、铝片与稀硫酸反应 |
| C、甲烷在空气中燃烧 |
| D、灼热的焦炭与CO2反应 |
下列装置不能构成原电池的是( )
A、 |
B、 |
C、 |
D、 |
每年的6月5日是世界环境日,在这天各国政府和人们都要进行相关的宣传和整治环境的大行动,环境问题已经成为困扰各国经济发展的重要因素.下列有关环境污染的说法中,不正确的是( )
| A、环境污染主要指大气污染、水源污染、土壤污染、食品污染及噪声等 |
| B、大气污染主要指CO、SO2、NmOn、CmHn及粉尘等 |
| C、大气中CO2浓度增大,是造成酸雨的主要原因 |
| D、从保护环境考虑,未来最理想的燃料是氢气 |
 如图为某原电池示意图,下列说法正确的是( )
如图为某原电池示意图,下列说法正确的是( )| A、电子沿导线流入铜电极 |
| B、锌原子失去电子变成Zn2+进入溶液 |
| C、原电池是电能转化为化学能的装置 |
| D、锌电极上发生还原反应 |
