题目内容
2.已知25℃下碳酸的电离常数K1=4.4×10-7,K2=4.7×10-11.下列有关碳酸溶液中各微粒浓度关系的说法正确的是( )| A. | c(H+)>c(OH-)>c(HCO${\;}_{3}^{-}$)+2c(CO${\;}_{3}^{2-}$) | B. | c(H+)>c(HCO${\;}_{3}^{-}$)>c(CO${\;}_{3}^{2-}$)>c(H2CO3) | ||
| C. | c(H2CO3)=2c(H+)+c(CO${\;}_{3}^{2-}$) | D. | c(H+)=c(OH-)+c(HCO${\;}_{3}^{-}$)+c(CO${\;}_{3}^{2-}$) |
分析 A.根据溶液中的电荷守恒分析;
B.碳酸是弱酸,在溶液中部分电离,而且电离程度较小,以第一步电离为主;
C.碳酸是弱酸,在溶液中部分电离;
D.根据溶液中的电荷守恒分析.
解答 解:A.碳酸溶液中存在的离子有H+、OH-、HCO3-、CO32-,阳离子所带正电荷总数等于阴离子所带负电荷总数,则溶液中的电荷守恒为c(H+)═c(OH-)+c(HCO3-)+2c(CO32-),故A正确;
B.碳酸是弱酸,在溶液中部分电离,而且电离程度较小,以第一步电离为主,所以溶液中碳酸分子的浓度最大,则c(H2CO3)>c(H+)>c(HCO3-),故B错误;
C.碳酸是弱酸,在溶液中部分电离,主要以碳酸分子的形式存在,所以c(H2CO3)≠2c(H+)+c(CO32-),故C错误;
D.碳酸溶液中存在的离子有H+、OH-、HCO3-、CO32-,阳离子所带正电荷总数等于阴离子所带负电荷总数,则溶液中的电荷守恒为c(H+)═c(OH-)+c(HCO3-)+c(CO32-),故D错误;
故选A.
点评 本题考查弱电解质电离及多元弱酸多步电离特点、溶液中微粒浓度之间的关系,题目难度中等,明确弱电解质的电离平衡及其影响为解答关键,注意明确电荷守恒、物料守恒的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
12.下列有机物的系统命名正确的是( )
| A. |  :3-甲基-2-戊烯 :3-甲基-2-戊烯 | B. |  :2-甲基-3-丁炔 :2-甲基-3-丁炔 | ||
| C. |  :1,3,4-三甲苯 :1,3,4-三甲苯 | D. |  :3,3-二甲基-4-乙基戊烷 :3,3-二甲基-4-乙基戊烷 |
10.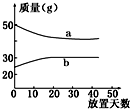 浓硫酸和2mol•L-1的稀硫酸,在实验室中敞口放置.它们的质量和放置天数的关系如右图所示,分析a、b曲线变化的原因是( )
浓硫酸和2mol•L-1的稀硫酸,在实验室中敞口放置.它们的质量和放置天数的关系如右图所示,分析a、b曲线变化的原因是( )
 浓硫酸和2mol•L-1的稀硫酸,在实验室中敞口放置.它们的质量和放置天数的关系如右图所示,分析a、b曲线变化的原因是( )
浓硫酸和2mol•L-1的稀硫酸,在实验室中敞口放置.它们的质量和放置天数的关系如右图所示,分析a、b曲线变化的原因是( )| A. | a升华、b冷凝 | B. | a蒸发、b吸水 | C. | a蒸发、b潮解 | D. | a冷凝、b吸水 |
11.下列关于化学反应与能量的说法中不正确的是( )
| A. | 反应Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3•H2O+8H2O过程中的能量变化情况符合如图 | |
| B. | 氢氧燃料电池的总反应为:2H2+O2=2H2O | |
| C. | 化学平衡状态指的是反应物和生成物浓度不再改变时的状态 | |
| D. | 催化剂既能加快化学反应速率,又能提高原料利用率或转化率 |




 .
.