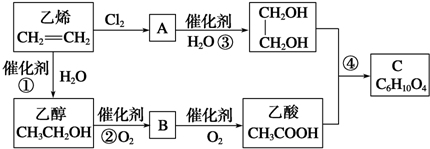
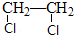题目内容
7.铝与过量的稀盐酸反应,为了加快反应速率,但是又不影响生成的氢气总量,可以采取的措施是( )| A. | 降低温度 | B. | 加入适量的水 | ||
| C. | 加入少量CuSO4溶液 | D. | 加入浓度较大的盐酸 |
分析 铝与过量的稀盐酸反应,Al完全反应,保证Al的物质的量不变,且升高温度、增大氢离子浓度、增大Al的接触面积等,可加快反应速率,以此来解答.
解答 解:A.降低温度,反应速率减小,故A不选;
B.加入适量的水,氢离子浓度减小,反应速率减小,故B不选;
C.加入少量CuSO4溶液,Al置换出Cu,构成原电池加快反应速率,但Al与酸反应生成的氢气减少,故C不选;
D.加入浓度较大的盐酸,氢离子浓度增大,反应速率加快,且生成氢气不变,故D选;
故选D.
点评 本题考查化学反应速率的影响因素,为高频考点,把握温度、浓度、原电池等对反应速率的影响为解答的关键,侧重分析与应用能力的考查,注意生成氢气的量不变易被忽略,题目难度不大.

练习册系列答案
相关题目
16.下列性质的递变中,正确的是( )
| A. | O、S、Na的原子半径依次增大 | B. | LiOH、NaOH、KOH的碱性依次减弱 | ||
| C. | NH3、H2O(气态)、HF的稳定性依次减弱 | D. | Cl2、Br2、I2的氧化性依次增强 |
17.下列叙述中正确的是(NA为阿伏加德罗常数)( )
| A. | 1.7 g的羟基中含有的电子数为NA | |
| B. | 标准状况下,11.2 L四氯化碳所含的原子数为2NA | |
| C. | 常温常压下,18 g H2O含有的原子数为3NA | |
| D. | 5.6 g金属铁变为离子时失去的电子数为0.2NA |
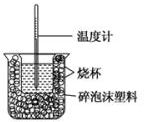 已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热.现利用如图装置进行中和热的测定,请回答下列问题:
已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热.现利用如图装置进行中和热的测定,请回答下列问题: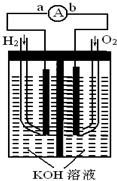 燃料电池是一种能量转换效率高、对环境友好的化学电源,图为一种氢氧燃料电池的结构装置.
燃料电池是一种能量转换效率高、对环境友好的化学电源,图为一种氢氧燃料电池的结构装置.