题目内容
17.常温下,下列溶液中有关说法正确的是( )| A. | 浓度均为0.01 mol•L-1的醋酸和硫酸溶液中分别加入足量锌片,生成H2的起始速率相等 | |
| B. | 0.1 mol•L-1的NaHCO3溶液中:[Na+]=[HCO3-]+[CO32-]+[H2CO3] | |
| C. | pH=11的氨水与pH=3的盐酸等体积混合:[Cl-]=[NH4+]>[OH-]=[H+] | |
| D. | 将0.1 mol的CH3COOH和0.1 mol的CH3COONa溶于水中,配成1L混合溶液.测得溶液的pH<7,则混合液中[CH3COO-]<[Na+] |
分析 A.醋酸是弱电解质,部分电离,硫酸是强电解质,完全电离,酸中氢离子浓度越大开始时反应速率越大;
B.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
C.常温下pH=11的氨水浓度大于pH=3的盐酸浓度,二者等体积混合氨水有剩余,溶液呈碱性;
D.等物质的量浓度的醋酸和醋酸钠溶液,混合溶液pH<7,溶液呈酸性,说明醋酸电离程度大于醋酸根离子水解程度,结合电荷守恒判断.
解答 解:A.酸中氢离子浓度越大开始时反应速率越大,醋酸是弱电解质,部分电离,硫酸是强电解质,完全电离,等物质的量浓度的醋酸和硫酸,硫酸中氢离子浓度大于醋酸,所以反应速率硫酸大于醋酸,故A错误;
B.任何电解质溶液中都存在物料守恒,根据物料守恒得:[Na+]=[HCO3-]+[CO32-]+[H2CO3],故B正确;
C.常温下pH=11的氨水浓度大于pH=3的盐酸浓度,二者等体积混合氨水有剩余,溶液呈碱性,所以[OH-]>[H+],结合电荷守恒得:[Cl-]<[NH4+],弱电解质电离程度很小,所以离子浓度大小顺序是:[NH4+]>[Cl-]>[OH-]>[H+],故C错误;
D.等物质的量浓度的醋酸和醋酸钠溶液,混合溶液pH<7,溶液呈酸性,则[OH-]<[H+],说明醋酸电离程度大于醋酸根离子水解程度,结合电荷守恒得[CH3COO-]>[Na+],弱电解质电离程度很小,所以离子浓度大小顺序是[CH3COO-]>[Na+]>[H+]>[OH-],故D错误;
故选B.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质及其性质是解本题关键,注意电荷守恒及物料守恒的灵活运用,注意溶液导电能力、反应速率与离子浓度有关,与电解质强弱无关,为易错点.

练习册系列答案
相关题目
7.下列关于物质用途的说法中,不正确的是( )
| A. | 硅酸钠可用于制备硅胶和木材防火剂等 | |
| B. | 氧化铝熔点高可用作耐火材料 | |
| C. | 晶体硅可用于制造光导纤维 | |
| D. | 氯水和臭氧可用于自来水消毒 |
8.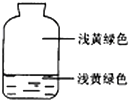 向盛有氯气的集气瓶中,注入约五分之一的下列液体并轻轻振荡,观察到的现象记录如图所示,判断瓶中注入的液体是( )
向盛有氯气的集气瓶中,注入约五分之一的下列液体并轻轻振荡,观察到的现象记录如图所示,判断瓶中注入的液体是( )
 向盛有氯气的集气瓶中,注入约五分之一的下列液体并轻轻振荡,观察到的现象记录如图所示,判断瓶中注入的液体是( )
向盛有氯气的集气瓶中,注入约五分之一的下列液体并轻轻振荡,观察到的现象记录如图所示,判断瓶中注入的液体是( )| A. | AgNO3溶液 | B. | NaOH溶液 | C. | 水 | D. | 石蕊溶液 |
5.能源与人类的生活和社会发展密切相关,下列关于能源开发和利用的说法中不正确的是( )
| A. | 因地制宜开发利用风能、水能、地热能、潮汐能 | |
| B. | 大力推广并充分利用太阳能 | |
| C. | 合理、安全开发利用氢能、核能 | |
| D. | 能源都是通过化学反应获得的 |
12.下列有关说法不正确的是( )
| A. | 配制SnCl2溶液时,首先用盐酸酸化蒸馏水,然后加入SnCl2晶体 | |
| B. | 加热CH3COONa溶液(预先滴有少量酚酞),溶液颜色变深 | |
| C. | 常温下,Fe(NO3)3溶液中由水电离产生的[H+]等于10-10 mol•L-1 | |
| D. | NaHCO3作为发酵粉使用时,加入少量的明矾在水中能起到酸的作用 |
2.下列说法正确的是( )
| A. | 氧化还原反应的判断依据是看反应前后元素化合价是否发生变化 | |
| B. | 根据是否只含一种元素将物质分为纯净物和混合物 | |
| C. | 根据水溶液是否能导电将化合物分为电解质和非电解质 | |
| D. | 根据是否有丁达尔现象将分散系分为溶液和胶体 |
12.已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法正确的是( )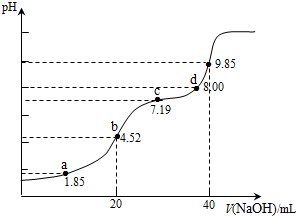

| A. | a点所得溶液中:2c(H2SO3)+c(SO32-)=0.1 mol•L-1 | |
| B. | b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | |
| C. | c点所得溶液中:c(Na+)<3c($HS{{{O}_{3}}^{-}}_{\;}$) | |
| D. | d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-) |