题目内容
2.下列说法正确的是( )| A. | 氧化还原反应的判断依据是看反应前后元素化合价是否发生变化 | |
| B. | 根据是否只含一种元素将物质分为纯净物和混合物 | |
| C. | 根据水溶液是否能导电将化合物分为电解质和非电解质 | |
| D. | 根据是否有丁达尔现象将分散系分为溶液和胶体 |
分析 A.氧化还原反应的特征是元素化合价变化;
B.根据构成物质的种类多少,把物质分为纯净物和混合物;
C.熔融状态导电性也是化合物分为电解质和非电解质的依据;
D.分散系的本质区别是分散质微粒的直径大小.
解答 解:A.氧化还原反应的特征是元素化合价变化,也是判断的依据,故A正确;
B.根据构成物质的分子多少,把物质分为纯净物和混合物,不是元素种类,故B错误;
C.区别电解质和非电解质的方法在熔融状态下的导电性,也可以区分化合物,故C错误;
D.分散系的本质区别是分散质微粒的直径大小;1nm-100nm为胶体;小于1nm为溶液,大于100nm为浊液,不是丁达尔现象,故D错误.
故选A.
点评 本题考查了氧化还原反应的特征类型应用,分散系的本质特征,电解质非电解质的本质区别,混合物的组成特征,基础题,需要熟练掌握.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
12.下列实验方法正确的是( )
| A. | 要使AlCl3溶液中Al3+全部沉淀出来可使用氨水 | |
| B. | 某气体能使品红溶液褪色,该气体一定为SO2 | |
| C. | 用饱和NaHCO3溶液除去混在Cl2中的HCl气体 | |
| D. | 用Cl2除去Fe2(SO4)3溶液中的少量FeSO4 |
13.随着卤素原子序数递增,下列说法正确的是( )
| A. | 单质的熔、沸点逐渐降低 | B. | 单质的氧化性逐渐减弱 | ||
| C. | 阴离子的还原性逐渐减弱 | D. | 气态氢化物稳定性逐渐增强 |
10.下列化合物不能由两种单质直接化合而成的是( )
| A. | FeCl2 | B. | Na2S | C. | Na2O2 | D. | SO2 |
17.常温下,下列溶液中有关说法正确的是( )
| A. | 浓度均为0.01 mol•L-1的醋酸和硫酸溶液中分别加入足量锌片,生成H2的起始速率相等 | |
| B. | 0.1 mol•L-1的NaHCO3溶液中:[Na+]=[HCO3-]+[CO32-]+[H2CO3] | |
| C. | pH=11的氨水与pH=3的盐酸等体积混合:[Cl-]=[NH4+]>[OH-]=[H+] | |
| D. | 将0.1 mol的CH3COOH和0.1 mol的CH3COONa溶于水中,配成1L混合溶液.测得溶液的pH<7,则混合液中[CH3COO-]<[Na+] |
7.下列说法中正确的是( )
①有大量的氯气泄漏时,应用浸有弱碱性溶液的毛巾捂住口鼻向低处跑
②钠在空气中加热,钠块先熔成光亮的银白色小球后燃烧
③Fe2O3可以做油漆的颜料
④用明矾做净水剂除去水中的悬浮物
⑤NaOH溶于水呈碱性,故可用于治疗胃酸过多.
①有大量的氯气泄漏时,应用浸有弱碱性溶液的毛巾捂住口鼻向低处跑
②钠在空气中加热,钠块先熔成光亮的银白色小球后燃烧
③Fe2O3可以做油漆的颜料
④用明矾做净水剂除去水中的悬浮物
⑤NaOH溶于水呈碱性,故可用于治疗胃酸过多.
| A. | ①③④ | B. | ②③④ | C. | ①②⑤ | D. | ②③⑤ |
14.孔雀石的主要成分为Cu2(OH)2CO3,还含少量二价铁和三价铁的氧化物及硅的氧化物.以下是实验室以孔雀石为原料制备CuSO4•5H2O晶体的流程图:
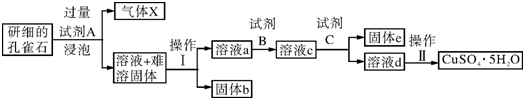
(1)试剂A的化学式是H2SO4;操作Ⅰ的名称是过滤;
(2)生成气体X的化学方程式为:Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑.
(3)使用试剂B的目的是将溶液中的Fe2+转化为Fe3+,试剂B最好选用B
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
(4)已知:
①试剂C的使用是为了调节溶液的pH,使Fe3+转化为沉淀予以分离.试剂C宜选用D:
A.稀硫酸 B.NaOH溶液 C.氨水 D.CuO
②为完全除去溶液c中的Fe3+而又不使Cu2+沉淀,则应调节溶液pH的范围为3.7-4.8.
(5)请设计一种实验方案检验溶液中Fe3+是否完全除去(写出操作步骤、现象和结论)取待检溶液少许,加入KSCN溶液,若溶液不变红色,说明Fe3+已完全除去;若溶液变红色,则说明Fe3+未完全除去.

(1)试剂A的化学式是H2SO4;操作Ⅰ的名称是过滤;
(2)生成气体X的化学方程式为:Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑.
(3)使用试剂B的目的是将溶液中的Fe2+转化为Fe3+,试剂B最好选用B
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
(4)已知:
| 物质 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀时的pH | 2.3 | 4.8 |
| 完全沉淀时的pH | 3.7 | 6.7 |
A.稀硫酸 B.NaOH溶液 C.氨水 D.CuO
②为完全除去溶液c中的Fe3+而又不使Cu2+沉淀,则应调节溶液pH的范围为3.7-4.8.
(5)请设计一种实验方案检验溶液中Fe3+是否完全除去(写出操作步骤、现象和结论)取待检溶液少许,加入KSCN溶液,若溶液不变红色,说明Fe3+已完全除去;若溶液变红色,则说明Fe3+未完全除去.
11.下列物质见光不会分解的是( )
| A. | (NH4)2SO4 | B. | HClO | C. | HNO3 | D. | AgNO3 |
17.有关阿佛加德罗常数(NA),下列说法中正确的是( )
| A. | 1 mol SiO2晶体中,含有2NA个Si-O共价键 | |
| B. | 常温下,4.4 g CO2和N2O混合物中所含有的原子数为0.3NA | |
| C. | 0.2 mol Cl2溶解于等体积的水中,转移电子数为0.2NA | |
| D. | 标准状况下,11.2L 四氯化碳所含分子数为0.5NA |