题目内容
将一定量的NaHCO3和Na2O2的混合物置于一密闭容器中充分加热,反应中转移的电子数为1mol,下列说法一定正确的是( )
| A、混合物中NaHCO3和Na2O2物质的量一定相等 |
| B、容器中肯定有0.5molO2 |
| C、反应后,容器中的固体只有Na2CO3 |
| D、反应后,容器中一定没有H2O |
考点:钠的重要化合物
专题:元素及其化合物
分析:反应的方程式有2NaHCO3
Na2CO3+CO2↑+H2O、2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑等,反应Na2O2中O元素化合价由-1价变化为0价、-2价,转移1mol电子,则生成0.5molO2,以此解答该题.
| ||
解答:
解:加热时NaHCO3分解:2NaHCO3
Na2CO3+CO2↑+H2O,
然后发生:2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,由方程式可知,转移1mol电子,则生成0.5molO2,可知反应1molNa2O2,如过氧化钠过量,则产物生成Na2CO3和NaOH,如过氧化钠不足,则产物为Na2CO3,可能有NaOH,不一定有水.
故选B.
| ||
然后发生:2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,由方程式可知,转移1mol电子,则生成0.5molO2,可知反应1molNa2O2,如过氧化钠过量,则产物生成Na2CO3和NaOH,如过氧化钠不足,则产物为Na2CO3,可能有NaOH,不一定有水.
故选B.
点评:本题考查了有关混合物反应的计算,题目难度较大,解题根据是根据题中信息判断反应产物的组成,注意质量守恒在化学计算中的应用,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用下列装置能实现相应实验目的是( )
A、 石油的蒸馏 |
B、 用大理石和稀盐酸制备CO2 |
C、 滴定管读数 |
D、 醋化反应 |
下列溶液一定呈中性的是( )
A、溶液中c(H+)=
| ||
| B、pH=7的溶液 | ||
| C、使石蕊试液呈紫色的溶液 | ||
| D、等体积0.1mol/L 硫酸与0.1mol/L的氢氧化钠溶液混合后的溶液 |
在一定条件下,一定量的A和B气体发生如下可逆反应:2A(g)+3B(g)?3C(g),只有反应到达平衡时才具有的性质是( )
| A、各物质的浓度之比为2:3:3 |
| B、混合物各物质的浓度相等 |
| C、A、B、C三种物质的浓度不随时间变化而变化 |
| D、ν正(A)、ν正(B)、ν正(C)之比为2:3:3 |
下列有关说法不正确的是( )
| A、镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
| B、手机上用的锂离子电池属于二次电池 |
| C、使用催化剂可改变工业合成NH3的反应限度 |
| D、生物质能本质上是太阳能 |
甲、乙是周期表中同主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( )
| A、х+2 | B、х+4 |
| C、х+8 | D、х+18 |




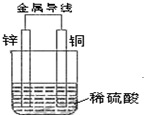 根据如图填空(涉及到电极填写具体物质的元素符号)
根据如图填空(涉及到电极填写具体物质的元素符号)