题目内容
在一定条件下,一定量的A和B气体发生如下可逆反应:2A(g)+3B(g)?3C(g),只有反应到达平衡时才具有的性质是( )
| A、各物质的浓度之比为2:3:3 |
| B、混合物各物质的浓度相等 |
| C、A、B、C三种物质的浓度不随时间变化而变化 |
| D、ν正(A)、ν正(B)、ν正(C)之比为2:3:3 |
考点:化学平衡状态的判断
专题:电离平衡与溶液的pH专题
分析:化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化.
解答:
解:A.反应到达平衡时,各物质的浓度之比取决于物质的起始物质的量和转化率,故平衡时,各物质的浓度之比不一定为2:3:3,故A错误;
B.反应到达平衡时,各物质的浓度大小关系取决于物质的起始物质的量和转化率,故平衡时,混合物各物质的浓度不一定相等,故B错误;
C.达到化学平衡状态时,物质的浓度不再发生变化,故A、B、C三种物质的浓度不随时间变化而变化,故C正确;
D.反应速率之比等于化学计量数之比,故ν正(A)、ν正(B)、ν正(C)之比为2:3:3与是否达到平衡无关,故D错误;
故选C.
B.反应到达平衡时,各物质的浓度大小关系取决于物质的起始物质的量和转化率,故平衡时,混合物各物质的浓度不一定相等,故B错误;
C.达到化学平衡状态时,物质的浓度不再发生变化,故A、B、C三种物质的浓度不随时间变化而变化,故C正确;
D.反应速率之比等于化学计量数之比,故ν正(A)、ν正(B)、ν正(C)之比为2:3:3与是否达到平衡无关,故D错误;
故选C.
点评:本题考查化学平衡状态的判断,题目难度不大.要注意把握平衡状态的特征.

练习册系列答案
相关题目
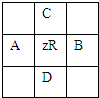 有原子序数为Z的元素R,在周期表中位于A、B、C、D四种元素中间,如图所示,
有原子序数为Z的元素R,在周期表中位于A、B、C、D四种元素中间,如图所示,A、B、C、D四种元素的原子序数之和不可能是( )
| A、4Z | B、4Z+10 |
| C、4Z+5 | D、4Z+14 |
下列实验操作中错误的是( )
| A、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、蒸发结晶时应将溶液蒸干 |
| D、称量物质时先取小砝码,再依次取较大的砝码 |
已知合成氨反应的浓度数据如下当用氨气浓度的增加来表示该化学反应速率时,其速率为( )
| N2+3H2?2NH3 | |||
| 起始浓度mol/L | 1.0 | 3.0 | 0 |
| 2秒末浓度mol/L | 0.6 | 1.8 | 0.8 |
| A、0.2 mol/(L?s) |
| B、0.4 mol/(L?s) |
| C、0.6 mol/(L?s) |
| D、0.8 mol/(L?s) |
将一定量的NaHCO3和Na2O2的混合物置于一密闭容器中充分加热,反应中转移的电子数为1mol,下列说法一定正确的是( )
| A、混合物中NaHCO3和Na2O2物质的量一定相等 |
| B、容器中肯定有0.5molO2 |
| C、反应后,容器中的固体只有Na2CO3 |
| D、反应后,容器中一定没有H2O |
在酸性溶解中能大量共存的一组离子是( )
| A、Na+、Al3+、Cl-、CO32- |
| B、Na+、Fe2+、SO42-、NO3- |
| C、K+、Ca2+、Cl-、NO3- |
| D、K+、NH4+、OH-、SO42- |
书写热化学方程式要注明物质的聚集状态,原因是( )
| A、具体说明反应的情况 |
| B、说明反应条件 |
| C、物质呈现的状态与反应焓变有关 |
| D、物质呈现的状态与生成什么物质有关 |
根据下列四种金属的熔沸点,判断其中不能形成合金的是( )
| Na | Cu | Al | Fe | |
| 熔点/℃ | 97.5 | 1083 | 660 | 1535 |
| 沸点/℃ | 883 | 2595 | 2200 | 3000 |
| A、Na和Al |
| B、Cu和Fe |
| C、Cu和Al |
| D、Na和Fe |