题目内容
1. 如图为A、B、C三种物质的溶解度曲线,据图回答下列问题:
如图为A、B、C三种物质的溶解度曲线,据图回答下列问题:(1)t2℃时,A、B、C三种物质的溶解度由小到大顺序是A>B>C.当温度为t1℃时.物质A与物质C的溶解度相等.
(2)要使接近饱和的溶液C变为饱和溶液,可采取的方法是增加溶质或蒸发溶剂或升高温度(只填一种).
(3)将t2℃时三种物质等质量的饱和溶液分别降温到0℃,析出溶质最多的是A,无溶质析出的是C.若将含有少量B的溶液A中结晶析出A,宜采用的方法是冷却热饱和溶液或降温结晶.
(4)t2℃时,若将30gA物质放入50g水中,充分搅拌,所得溶液的质量是31.03%.若将t1℃三种物质的饱和溶液分别降到t2℃时,则三种溶液中溶质的质量分数由大到小的顺序是B>A>C.
分析 (1)运用固体溶解度曲线可比较同一温度下不同物质的溶解度大小;根据溶解度曲线:交点的含义是在某温度下,两物质的溶解度相等;
(2)由C的溶解度受温度的影响的变化趋势,可以确定接近饱和的C物质溶液变为饱和的溶液采取的一种措施;
(3)等质量的饱和溶液降低相同的温度,溶解度变化幅度大的析出晶体多,溶解度随温度的升高而减小的降温无溶质析出;根据溶解度曲线可以知道物质的溶解度受温度影响情况,进而分析提纯物质的方法;
(4)据t2℃时A的溶解度分析回答;据三种物质的溶解度随温度变化情况及饱和溶液中溶质的质量分数计算方法,分析溶液中溶质的质量分数变化.
解答 解:(1)由t2℃时,A、B、C三种物质曲线的位置关系,三种物质的溶解度由小到大的顺序:A>B>C;从图中我们可以看出在t1℃时,A、C两物质溶解度曲线的交点表示在t1℃时,A、C两物质的溶解度相同;
故答案为:A>B>C;t1;
(2)C的溶解度随着温度的升高而减小,要使接近饱和的丙物质溶液变为饱和,可以采取增加溶质、蒸发溶剂、升高温度等方法.
故答案为:增加溶质、蒸发溶剂、升高温度;
(3)因为A、B两种固体物质的溶解度,都是随温度升高而增大,而C的溶解度随温度的升高而减少,所以将t2℃时三种物质等质量的饱和溶液分别降温到0℃,析出溶质最多的是A,无溶质析出的是C;B的溶解度受温度影响不大,A的溶解度受温度影响较大,所以A中含少量的B时,采取冷却热饱和溶液或降温结晶会使A大量的结晶析出,
故答案为:A;C;冷却热饱和溶液或降温结晶;
(4)t2℃时A的溶解度是45g,将30gA物质放入50g水中,充分搅拌最多溶解22.5,所得溶液的质量是$\frac{22.5}{22.5+50}$×100%=31.03%;
A、B的溶解度随温度的升高而增大,C的溶解度随温度的升高而减小,所以若将三种物质的饱和溶液分别升温到t2℃时,A、B的溶解度不变,与升温前相等,C析出晶体,溶质质量分数减小,据饱和溶液中溶质质量分数的计算式=$\frac{溶解度}{溶解度+100}$×100%,可以知道:溶解度越大质量分数也就越大,t2℃时B的溶解度大于A,大于t2℃时C的溶解度,则三种溶液中溶质的质量分数由大到小的顺序是:B>A>C;
故答案为:31.03%;B>A>C.
点评 本题主要考查了固体溶解度曲线的有关知识及固体溶解度的概念、饱和溶液中溶质的质量分数随温度变化的变化情况,培养学生分析问题、解决问题的能力和理解能力,根据固体物质的溶解度曲线可以:①知道某物质在某温度下的溶解度,②比较不同物质在同一温度下的溶解度大小,③判断某物质的溶解度随温度变化的变化情况.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| A. | 1L水中含有1molH2SO4 | |
| B. | 1L溶液中含有1molH+ | |
| C. | 将98gH2SO4溶于1L水中配成上述溶液 | |
| D. | 1L硫酸溶液中含有96gSO42- |
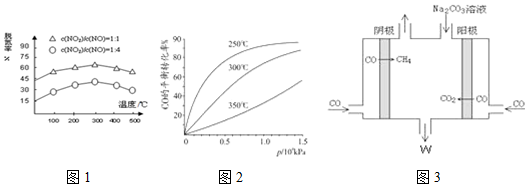
 科研生产中常涉及碳的化合物.请回答下列问题:
科研生产中常涉及碳的化合物.请回答下列问题:I、700℃时,向容积为3L的密闭容器中充人一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):
| 反应时间/min | n[CO(g)]mol | n[H2O(g)]mol |
| 0 | 1.8 | 0.9 |
| t1 | 1.2 | |
| t2 | 0.3 |
(2)保持其他条件不变,起始时向容器中充入0.9mol CO和1.8mol H2O(g),达平衡时,CO2的物质的量浓度c(CO2)=0.3mol/L
(3)判断该反应是否达到平衡的依据为cd(填正确选项前的字母):
a.压强不随时间改变 b.密度不随时间改变
c.c(CO)不随时间改变 d.单位时间里生成CO和CO2的物质的量相等
II、CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)?CH3OH(g)
CO在不同温度下平衡转化率与压强的关系如图所示,该反应的△H<0(填“>”、“=”或“<”),实际生产条件控制在250℃,1.3×l04kPa左右,选择此压强而不选择更高压强的理由是在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低
III、某温度下,将1mol CO和1mol H2O(g)充入某固定容积的反应容器中,一段时间后达到平衡:
CO(g)+H2O(g)?CO2(g)+H2(g),此时有$\frac{2}{3}$的CO转化为CO2.
(1)达平衡时H2O(g)的转化率是66.7%
(2)相同条件下,开始时向容器中充入1mol CO2、1mol H2、1mol H2O和0.2mol CO,则开始时的速率
v(正)<v(逆)(填“>”、“<”或“=”)
| A. | 电解稀硫酸,实质是电解水,溶液pH不变 | |
| B. | 电解氢氧化钠稀溶液,溶液浓度增大,pH变小 | |
| C. | 电解氯化钠溶液,溶液浓度减小,pH不变 | |
| D. | 电解硫酸铜溶液,要消耗OH-溶液,pH变小 |
| A. | 向AgNO3溶液中加入Cu粉:Cu+2Ag+═Cu2++2Ag | |
| B. | 向CaCl2溶液中通入CO2:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| C. | 饱和FeCl3溶液滴入沸水中制Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| D. | CuSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-═BaSO4↓ |
| A. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,又把过量的试剂倒入试剂瓶中 | |
| B. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 在100mL的量筒里稀释浓硫酸溶液50mL | |
| D. | 用浓硫酸配制一定浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
| 选项 | 实验目的 | 操作方法 | 原理 |
| A | 验证淀粉水解产物是否具有还原性 | 取水解液于试管中加入新制氢氧化铜悬浊液,加热煮沸 | 水解产物为葡萄糖,与新制氢氧化铜悬浊液共热出现砖红色沉淀 |
| B | 除去溴苯中的溴 | 将混合物倒入分液漏斗中,加入苯,充分振荡,静置,分液 | 溴易溶于苯 |
| C | 制备氢氧化铁胶体 | 在氢氧化钠溶液中加入饱和FeCl3溶液,煮沸 | 加入NaOH促进FeCl3溶液水解,从而得到氢氧化铁胶体 |
| D | 验证CH3COONa溶液中存在水解平衡 | 取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体(水溶液呈中性),观察溶液颜色变化 | 加入醋酸铵固体,使CH3COONa溶液水解平衡逆向移动,颜色变浅 |
| A. | A | B. | B | C. | C | D. | D |