题目内容
下列化学反应中,离子方程式表示正确的是( )
| A、用小苏打(NaHCO3)治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
| B、铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| C、往氢氧化钠中滴加氯化铜溶液:Cu2++2OH-=Cu(OH)2↓ |
| D、铜片插入硝酸银溶液:Cu+Ag+═Cu2++Ag |
考点:离子方程式的书写
专题:离子反应专题
分析:A、碳酸氢根离子是多元弱酸根离子不拆;
B、盐酸是弱氧化剂只能将铁氧化为亚铁离子;
C、氢氧化铜不溶于水,离子方程式中应写成化学式;
D、得失电子不守恒,不符合客观事实.
B、盐酸是弱氧化剂只能将铁氧化为亚铁离子;
C、氢氧化铜不溶于水,离子方程式中应写成化学式;
D、得失电子不守恒,不符合客观事实.
解答:
解:A、碳酸氢根离子是多元弱酸根离子不拆,正确的离子方程式为HCO3-+H+=CO2↑+H2O,故A正确;
B、盐酸是弱氧化剂只能将铁氧化为亚铁离子,正确的离子方程式为Fe+2H+═Fe2++H2↑,故B错误;
C、氢氧化铜不溶于水,离子方程式中应写成化学式,离子方程式为Cu2++2OH-=Cu(OH)2↓,故C正确;
D、得失电子不守恒,不符合客观事实,正确的离子方程式为Cu+2Ag+═Cu2++2Ag,故D错误;
故选AC.
B、盐酸是弱氧化剂只能将铁氧化为亚铁离子,正确的离子方程式为Fe+2H+═Fe2++H2↑,故B错误;
C、氢氧化铜不溶于水,离子方程式中应写成化学式,离子方程式为Cu2++2OH-=Cu(OH)2↓,故C正确;
D、得失电子不守恒,不符合客观事实,正确的离子方程式为Cu+2Ag+═Cu2++2Ag,故D错误;
故选AC.
点评:本题考查离子方程式的书写,题目难度不大,注意从化学式、离子符号、电荷守恒以及是否符合反应实际的角度分析.

练习册系列答案
 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
可逆反应3H2+N2?2NH3达到平衡的标志是( )
①消耗3mol H2的同时生成2mol NH3
②1个N≡N键断裂的同时,有3个H-H键形成
③H2、N2与NH3的物质的量之比为3:1:2
④1个N≡N键断裂的同时,有6个N-H键断裂
⑤1个N≡N键断裂的同时,有6个N-H键形成.
①消耗3mol H2的同时生成2mol NH3
②1个N≡N键断裂的同时,有3个H-H键形成
③H2、N2与NH3的物质的量之比为3:1:2
④1个N≡N键断裂的同时,有6个N-H键断裂
⑤1个N≡N键断裂的同时,有6个N-H键形成.
| A、①②⑤ | B、②④ |
| C、①②③④ | D、全部 |
下列物质分别与CuSO4、NaCl、Fe2(SO4)3、MgSO4等溶液混合时,产生的现象各不相同的是( )
| A、盐酸 | B、氢氧化钾溶液 |
| C、氯化钡溶液 | D、硫酸钠溶液 |
白酒、食醋、蔗糖、淀粉是家庭厨房中常用的烹调剂,利用这些物质能完成的实验是( )
| A、鉴别食盐和小苏打 |
| B、检验食盐中是否含KIO3 |
| C、检验自来水中是否含有氯离子 |
| D、检验白酒中是否含甲醇 |
铜锌原电池(如图)工作时,下列叙述正确的是( )
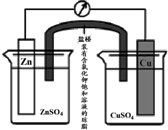

| A、在外电路中,电流从Zn极流向Cu极 |
| B、盐桥中的Cl-移向CuSO4溶液 |
| C、当负极减小65g时,正极增加65g |
| D、电池的总反应为 Zn+Cu2+=Zn2++Cu |
下列说法正确的是( )
| A、已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ?mol-1,则H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)△H=2×(-57.3)kJ?mol-1 | ||||
| B、已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ?mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | ||||
C、500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)
| ||||
D、葡萄糖的燃烧热是2 800 kJ?mol-1,则
|
下列实验操作正确的是( )
| A、在2mL10%的氢氧化钠溶液中滴入2%的硫酸铜溶液4~6滴,配制新制氢氧化铜悬浊液,检验醛基 |
| B、实验室制乙烯时,迅速升温到140℃ |
| C、用乙醇和浓硫酸除去乙酸乙酯中混有的少量乙酸 |
| D、用苯、2mol/L的硝酸和3mol/L的硫酸制硝基苯 |
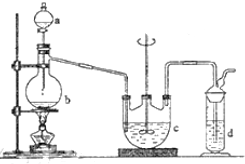 硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.回答下列问题:
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.回答下列问题: