题目内容
铜锌原电池(如图)工作时,下列叙述正确的是( )
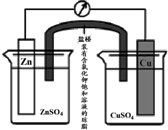

| A、在外电路中,电流从Zn极流向Cu极 |
| B、盐桥中的Cl-移向CuSO4溶液 |
| C、当负极减小65g时,正极增加65g |
| D、电池的总反应为 Zn+Cu2+=Zn2++Cu |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:锌比铜活泼,锌为负极,发生氧化反应,铜为正极,发生还原反应,原电池工作时,阳离子向正极移动,阴离子向负极移动,电子从负极经外电路流向正极,以此解答该题.
解答:
解:A.锌为负极,铜为正极,电流从铜极流向锌极,故A错误;
B.原电池工作时,阴离子向负极移动,即向硫酸锌溶液移动,故B错误;
C.负极电极方程式为Zn-2e-═Zn2+,正极为Cu2++2e-=Cu,负极减小65g时,转移2mol电子,则正极增加64g,故C错误;
D.电池反应原理为锌与硫酸铜溶液反应置换铜,总反应为Zn+Cu2+=Zn2++Cu,故D正确.
故选D.
B.原电池工作时,阴离子向负极移动,即向硫酸锌溶液移动,故B错误;
C.负极电极方程式为Zn-2e-═Zn2+,正极为Cu2++2e-=Cu,负极减小65g时,转移2mol电子,则正极增加64g,故C错误;
D.电池反应原理为锌与硫酸铜溶液反应置换铜,总反应为Zn+Cu2+=Zn2++Cu,故D正确.
故选D.
点评:本题考查原电池知识,为高考常见题型和高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,有利于培养学生的良好的科学素养,提高学习的积极性,难度中等,注意把握原电池的工作原理.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法正确的是( )
| A、强电解质导电能力一定强 |
| B、含强极性键的共价化合物一定是强电解质 |
| C、强电解质的饱和溶液一定是浓溶液 |
| D、强电解质的水溶液中一定存在电离平衡 |
室温下,在PH=12的某溶液中,分别有甲、乙、丙、丁四位同学计算出由水电离出的C(OH-)的数据分别为甲:1.0×10-7mol.L-1;乙:1.0×10-6mol.L-1;丙:1.0×10-2mol.L-1;丁:1.0×10-12mol.L-1.其中你认为可能正确的数据是( )
| A、甲、乙 | B、乙、丙 |
| C、丙、丁 | D、乙、丁 |
下列离子或分子在溶液中能大量共存,通NO2后仍能大量共存的一组是( )
| A、K+、Na+、Br-、SiO32- |
| B、H+、Fe2+、SO42-、Cl- |
| C、K+、Ca2+、Cl-、NO3- |
| D、K+、Al3+、NH3?H2O、NO3- |
在恒温恒容条件下,一定能使反应A(g)+B(s)?C(g)+D(g)的反应速率增大的措施是( )
| A、减小A或B的用量 |
| B、减小C的量 |
| C、增大B的量 |
| D、增大D的量 |
下列化学反应中,离子方程式表示正确的是( )
| A、用小苏打(NaHCO3)治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
| B、铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| C、往氢氧化钠中滴加氯化铜溶液:Cu2++2OH-=Cu(OH)2↓ |
| D、铜片插入硝酸银溶液:Cu+Ag+═Cu2++Ag |
230Th和232Th是钍的两种同位素,232Th可以转化成
U.下列有关Th、U的说法正确的是( )
233 92 |
A、铀(U)是92号元素,
| ||
| B、Th元素的相对原子质量是231 | ||
| C、232Th转换成233U是化学变化 | ||
| D、230Th和232Th的性质不同 |
下列关于物质的量、摩尔质量的叙述正确的是( )
| A、0.012 kg 12C中含有约6.02×1023个碳原子 |
| B、1 mol H2O中含有2 mol氢和1 mol氧 |
| C、氢氧化钠的摩尔质量是40 g |
| D、2 mol水的摩尔质量是1 mol水的摩尔质量的2倍 |