题目内容
6.钙元素是人体必需的常量元素,所有的细胞都需要钙元素.正常人体血液含Ca2+为2.2×10-3~2.7×10-3mol.L-1,现抽取某人体血样10mL,稀释后用草酸铵[(NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙(CaC2O4)沉淀;过滤,洗涤,将得到的沉淀用稀H2SO4溶解可得草酸(H2C2O4),并用5.0×10-3mol.L-1的KMnO4溶液滴定草酸.当达到滴定终点时,消耗KMnO4溶液2.00mL.滴定时,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O(1)用KMnO4溶液滴定H2C2O4时,应装在酸式滴定管(填“酸式滴定管”,“碱式滴定管”或“移液管”)中,滴定到终点的现象是待测液刚出现紫色且半分钟内不褪色
(2)试通过计算判断此人血液中含钙量是否正常.
分析 (1)KMnO4溶液具有强氧化性,可氧化橡胶管,且高锰酸钾溶液为紫色,滴定终点时紫色出现;
(2)由信息及2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O可知,存在5Ca2+~5CaC2O4~5H2C2O4~2KMnO4,以此计算.
解答 解:(1)KMnO4溶液具有强氧化性,可氧化橡胶管,则KMnO4溶液应装在酸式滴定管中,且高锰酸钾溶液为紫色,滴定到终点的现象是待测液刚出现紫色且半分钟内不褪色,
故答案为:酸式滴定管;待测液刚出现紫色且半分钟内不褪色;
(2)由信息及2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O可知,存在5Ca2+~5CaC2O4~5H2C2O4~2KMnO4,
设10mL血样中c(Ca2+)=xmol/L,则
5Ca2+~5CaC2O4~5H2C2O4~2KMnO4,
5 2
0.01L×x 0.002L×5.0×10-3mol/L
$\frac{5}{2}=\frac{0.01L×x}{0.002L×5×1{0}^{-3}mol/L}$
50.01L×x×2=0.002L×5.0×10-3mol/L×5,
解得x=2.5×10-3mol/L,
正常人体血液含Ca2+为2.2×10-3~2.7×10-3mol.L-1,
可知此人血液中含钙量正常,
答:此人血液中含钙量正常,c(Ca2+)=2.5×10-3mol/L.
点评 本题考查物质含量的测定及计算,为高频考点,把握滴定原理的应用、关系式的应用为解答的关键,侧重分析与计算能力的考查,注意分析钙离子与高锰酸钾的关系,题目难度中等.

| A. | 水电解生成氢气和氧气,说明水中含有氢分子和氧分子 | |
| B. | 用肥皂水不可以区分硬水和软水 | |
| C. | 将黄河水经沉降、过滤、吸附,灭菌等净化操作后,可供人们生活用水 | |
| D. | 水体有一定的自净功能,部分工业污水可直接排放 |
 如图,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则关于原来H2、O2的体积比下列正确的是( )
如图,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则关于原来H2、O2的体积比下列正确的是( )| A. | 4:17 | B. | 3:7 | C. | 8:13 | D. | 7:4 |
| A. | 标准状况下,22.4LNO与11.2LO2混合,混合气体所含分子数为NA | |
| B. | 1molAl3+含有的核外电子数为10NA | |
| C. | 常温常压下,1mol氮气含有的原子总数为2NA | |
| D. | 1L1mol/LFeCl3溶液全部制成胶体,其中含胶粒的数目小于NA |
| A. | 燃烧硫生成SO3 | B. | SO3与水反应生成H2SO4 | ||
| C. | SO2氧化成SO3需要使用催化剂 | D. | 主要设备是沸腾炉、接触室、吸收塔 |
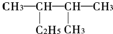 ,下列对该烷烃的系统命名中正确的是( )
,下列对该烷烃的系统命名中正确的是( )| A. | 3-甲基-2-乙基丁烷 | B. | 2-甲基-3-乙基丁烷 | ||
| C. | 2,3-二甲基戊烷 | D. | 3,4-二甲戊烷 |
| A. | 13.5g | B. | 9g | C. | 27g | D. | 0.33mol |
| A. | 滴加盐酸时,HCl是还原剂,Cl2是还原产物 | |
| B. | 已知Bi为第ⅤA族元素,上述实验说明Bi具有较强的非金属性 | |
| C. | 若有0.1 mol NaBiO3参加了反应,则整个过程转移电子0.4NA | |
| D. | 此实验条件下,物质的氧化性:KMnO4>NaBiO3>Cl2 |