题目内容
9. 我国的四大发明之一黑火药,爆炸时反应的化学方程式为:S+2KNO3+3C→K2S+3CO2↑+N2↑.请根据其中所含的元素回答下列问题:
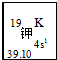
我国的四大发明之一黑火药,爆炸时反应的化学方程式为:S+2KNO3+3C→K2S+3CO2↑+N2↑.请根据其中所含的元素回答下列问题:(1)如图所示为元素周期表中钾元素框图,数据“39.10”表示的是K元素的相对原子质量;钾元素在周期表中的位置为第四周期ⅠA族.
(2)上述元素中,简单离子组成与氩原子相同,且离子半径最大的元素,其原子核外有5种不同能级的电子;已知其氧化物对应水化物能与氯单质反应,写出该水化物的电离方程式H2SO3?H++HSO3-.
(3)反应生成物中,属于非电解质的是CO2(写化学式);写出熔点最高的物质的电子式
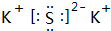 .
.(4)上述元素中属于同周期元素的非金属性由强到弱的顺序为O>N>C,从原子结构角度分析原因同周期原子半径从左到右依减小,原子核对核外电子的吸引力增强,得电子能力增强,非金属性增强.
分析 (1)K元素的相对原子质量为39.10,主族元素周期数=电子层数、主族族序最外层电子数;
(2)上述元素中S2-离子半径最大,根据能量最低原理书写其核外电子排布式,进而确定能级数目;亚硫酸与氯气能反应且亚硫酸为二元弱酸;
(3)二氧化碳属于非电解质,分子中C原子与O原子之间形成2对共用电子对;沸点最高是K2S,属于离子化合物,由钾离子与硫离子构成;
(4)同周期随原子序数增大元素的非金属性增强;根据同周期原子半径从左到右依减小进行分析.
解答 解:(1)39.10是K元素的相对原子质量,K元素原子外围电子排布为4s1,电子层数为4、最外层电子数为1,处于第四周期ⅠA族,
故答案为:K元素的相对原子质量;第四周期ⅠA族;
(2)上述元素中S2-离子半径最大,其核外电子排布式为1s22s22p63s23p6,有5种不同能级的电子;亚硫酸与氯气发生反应生成生成HCl与硫酸,亚硫酸是二元弱酸,电离方程式为:H2SO3?H++HSO3-,
故答案为:5;H2SO3?H++HSO3-;
(3)二氧化碳属于非电解质;沸点最高是K2S,属于离子化合物,由钾离子与硫离子构成,其电子式为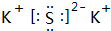 ,故答案为:CO2;
,故答案为:CO2;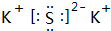 ;
;
(4)C、N、O同周期,同周期原子半径从左到右依减小,原子核对核外电子的吸引力增强,得电子能力增强,非金属性增强,故非金属性O>N>C;
故答案为:O>N>C;同周期原子半径从左到右依减小,原子核对核外电子的吸引力增强,得电子能力增强,非金属性增强.
点评 本题考查元素周期表、元素周期律、常用化学用语、氧化还原反应等,难度不大,(2)为易错点,学生容易想到硫酸而忽略亚硫酸.

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目
19.下列设计的实验方案能达到实验目的是( )
| A. | 制备Fe(OH)3胶体:在加热时,向0.1 mol•L-1FeCl3溶液中滴加NaOH溶液 | |
| B. | 配制pH=3的CH3COOH溶液:取1 mL 1 mol•L-1CH3COOH溶液加水至100 mL | |
| C. | 提纯含有少量溴的溴苯:向含有少量溴的溴苯中加入过量NaOH溶液充分振荡后,静置、分液,并除去有机相的水 | |
| D. | 比较AgCl、AgI的Ksp:向1 mL浓度均为2 mol•L-1的Cl-、I-的混合溶液中,加入1 mL 2 mol•L-1AgNO3溶液 |
20.NA表示阿伏伽德罗常数,下列判断正确的是( )
| A. | 在20g D2O中含有NA个氧原子 | |
| B. | 标准状况下,2.24 L三氧化硫中所含氧原子数为0.3 NA | |
| C. | 1 molCl2参加反应转移电子数一定为2NA | |
| D. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1 mol/L |
17.某物质有以下性质:①是电解质,②溶解时有化学键的破坏,③熔化时没有化学键的破坏,则该物质固态时属于( )
| A. | 原子晶体 | B. | 分子晶体 | C. | 离子晶体 | D. | 金属晶体 |
4.25℃时,纯水的电离度为α1,pH=11的氨水中水的电离度为α2;pH=3的盐酸中水的电离度为α3;若将上述氨水与盐酸等体积混合,所得溶液中水的电离度为α4,下列关系正确的( )
| A. | α1<α2<α3<α4 | B. | α3<α2<α1<α4 | C. | α2=α3<α4<α1 | D. | α2=α3<α1<α4 |
9.利用铜萃取剂M,通过如下反应实现铜离子的富集(如图1):
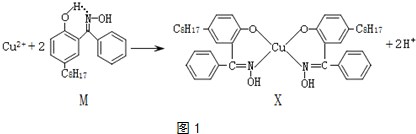
(1)X难溶于水、易溶于有机溶剂,其晶体类型为分子晶体.
(2)X中以sp2杂化、sp3杂化的原子的第一电离能由大到小顺序为N>O>C.
(3)上述反应中断裂和生成的化学键有be(填序号).
a.离子键 b.配位键 c.金属键 d.范德华力 e.共价键
(4)M与W(分子结构如图2)相比,M的水溶性小,更利于Cu2+的萃取.M水溶性小的主要原因是M能形成分子内氢键,使溶解度减小.
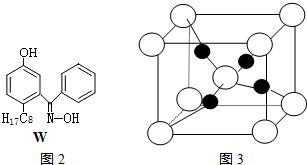
(5)硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒等功效.取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重如下表.回答下列问题:
图3是硫酸铜晶体分解得到一定温度的产物的晶胞(白球和黑球代表不同的原子).
①该温度是1000℃以上.
②铜原子的配位数是4.

(1)X难溶于水、易溶于有机溶剂,其晶体类型为分子晶体.
(2)X中以sp2杂化、sp3杂化的原子的第一电离能由大到小顺序为N>O>C.
(3)上述反应中断裂和生成的化学键有be(填序号).
a.离子键 b.配位键 c.金属键 d.范德华力 e.共价键
(4)M与W(分子结构如图2)相比,M的水溶性小,更利于Cu2+的萃取.M水溶性小的主要原因是M能形成分子内氢键,使溶解度减小.

(5)硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒等功效.取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重如下表.回答下列问题:
| 温度范围/℃ | 固体质量/g |
| 258~680 | 3.20 |
| 680~1000 | 1.60 |
| 1000以上 | 1.44 |
①该温度是1000℃以上.
②铜原子的配位数是4.
6.NA表示阿伏加德罗常数的值,则下列说法正确的是( )
| A. | 1 摩尔任何物质都含NA个原子 | |
| B. | 0.1 mol/L K2SO4溶液中含有 K+为0.2 NA | |
| C. | 7.1gCl2与足量的氢氧化钠溶液反应转移的电子数一定为0.2NA | |
| D. | 标准状况下,22.4L 以任意比混合的CO、CO2混合气体所含碳原子数约为NA |

