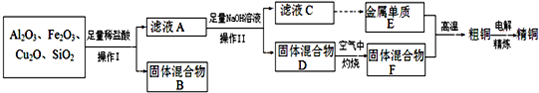
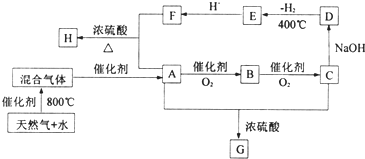
题目内容
关于键长、键能和键角,下列说法不正确的是( )
| A、键角是确定多分子立体结构(分子形状)的重要参数 |
| B、通过反应物和生成物分子中键能数据可以粗略预测反应热的大小 |
| C、键长越长,键能必越小,共价化合物必越稳定 |
| D、同种原子间形成的共价键键长长短总是遵循;叁键<双键<单键 |
考点:键能、键长、键角及其应用
专题:化学键与晶体结构
分析:A、键角与分子的立体结构有关;
B、反应热=反应物的总键能-生成物的总键能;
C、键长越长,作用力越小,键能越小,化合物越不稳定;
D、原子间键能越大,核间距越小,键长越短.
B、反应热=反应物的总键能-生成物的总键能;
C、键长越长,作用力越小,键能越小,化合物越不稳定;
D、原子间键能越大,核间距越小,键长越短.
解答:
解:A、键长和键角常被用来描述分子的空间构型,键角是描述分子立体结构的重要参数,故A正确;
B、反应热=反应物的总键能-生成物的总键能,则通过反应物和生成物分子中键能数据可以粗略预测反应热的大小,故B正确;
C、键能越大,键长越短,共价化合物越稳定,故C错误;
D、原子间键能越大,核间距越小,键长越短,键能的一般关系为为:叁键>双键>单键,则键长:叁键<双键<单键,故D正确;
故选:C.
B、反应热=反应物的总键能-生成物的总键能,则通过反应物和生成物分子中键能数据可以粗略预测反应热的大小,故B正确;
C、键能越大,键长越短,共价化合物越稳定,故C错误;
D、原子间键能越大,核间距越小,键长越短,键能的一般关系为为:叁键>双键>单键,则键长:叁键<双键<单键,故D正确;
故选:C.
点评:本题考查了化学键的键参数的含义和判断,掌握概念的内涵是解题关键,题目较简单,侧重于基础知识的考查.

练习册系列答案
相关题目
下列反应既属于氧化还原反应,又是吸热反应的是( )
| A、铝片与稀盐酸的反应 |
| B、Ba(OH)2.8H2O与NH4Cl的反应 |
| C、灼热的炭与CO2的反应 |
| D、甲烷在氧气中的燃烧反应 |
对于反应MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑,下列说法错误的是( )
| ||
| A、该反应是氧化还原反应 |
| B、MnO2发生还原反应 |
| C、HCl是还原剂 |
| D、若生成7.1 g Cl2,则转移0.1 mol电子 |
下列说法正确的是( )
| A、金属元素的原子最外层电子数越少,则该元素的金属性越强 |
| B、同周期元素原子半径和离子半径从左到右均依次减小 |
| C、第三周期非金属氧化物对应水化物的酸性从左到右依次增强 |
| D、第ⅦA族元素气态氢化物的还原性从上到下依次增强 |
已知Ka1(H2CO3)>K(HBrO)>Ka2(H2CO3),下列离子方程式或化学方程中不正确的是( )
| A、向NaHCO3溶液中滴加少量溴水:HCO3-+Br2═HBrO+Br-+CO2↑ |
| B、向Na2CO3溶液中滴加少量溴水:2CO32-+Br2+H2O═BrO-+Br-+2HCO3- |
| C、向NaBrO溶液中通入过量的CO2:CO2+2NaBrO+H2O═Na2CO3+2HBrO |
| D、向NaBrO溶液中通入少量的CO2:CO2+NaBrO+H2O═NaHCO3+HBrO |
下列化学用语表达正确的是( )
A、硝基苯的结构简式: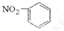 | ||
B、NH4Cl的电子式: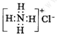 | ||
C、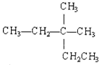 的名称为:3,3二甲基戍烷 的名称为:3,3二甲基戍烷 | ||
D、具有16个质子、16个种子和18个电子的微粒一定是
|