题目内容
下列反应既属于氧化还原反应,又是吸热反应的是( )
| A、铝片与稀盐酸的反应 |
| B、Ba(OH)2.8H2O与NH4Cl的反应 |
| C、灼热的炭与CO2的反应 |
| D、甲烷在氧气中的燃烧反应 |
考点:氧化还原反应,吸热反应和放热反应
专题:
分析:从元素的化合价是否发生变化的角度判断是否氧化还原反应,常见的吸热反应有:C和水、CuO等反应,大多数分解反应以及氢氧化钡晶体和氯化铵的反应等.
解答:
解:A.铝片与稀盐酸的反应为放热反应,故A错误;
B.Ba(OH)2.8H2O与NH4Cl的反应为吸热反应,但不是氧化还原反应,故B错误;
C.灼热的炭与CO2的反应为吸热反应,也为氧化还原反应,故C正确;
D.甲烷在氧气中的燃烧反应为放热反应,故D错误.
故选C.
B.Ba(OH)2.8H2O与NH4Cl的反应为吸热反应,但不是氧化还原反应,故B错误;
C.灼热的炭与CO2的反应为吸热反应,也为氧化还原反应,故C正确;
D.甲烷在氧气中的燃烧反应为放热反应,故D错误.
故选C.
点评:本题考查化学反应类型的判断,为高频考点,注意氧化还原反应的特征是化合价的升降,学习中注意归纳常见吸热反应以及放热反应,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子方程式正确的是( )
| A、铜氨溶液的制备:Cu2-+2NH3.H2O=Cu(NH3)22++2H2O |
| B、氢氧化钡溶液中滴加明矾溶液至Ba2+恰好完全沉淀:Ba2++30H-+SO42-+Al3+=BaSO4↓+Al(OH)3↓ |
C、水杨酸钠 通入过量的CO2; 通入过量的CO2;  +CO2+H2O→ +CO2+H2O→ +HCO3- +HCO3- |
| D、在氯化亚铁溶液中加入足量酸性高锰酸钾溶液:5Fe2++8H++Mn04-=5Fe3++Mn2++4H2O |
对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)△H=-444.3kJ/mol,且熵减小,在常温常压下该反应能自发进行,对反应的方向起决定作用的是( )
| A、焓变 | B、温度 | C、压强 | D、熵变 |
2012年6月24日,“蛟龙”号载人潜入器成功下滑至西太平洋马里亚纳海沟7020米处.同年6月27日,中国“蛟龙”再次刷新“中国深度”-下潜7062米.“蛟龙”号载人潜水器的外壳是耐超高压的钛合金,下面有关合金的说法正确的是( )
| A、钛合金是一种新型金属单质 |
| B、钛合金熔点比成分金属高,且硬度也更大 |
| C、目前人类使用最广泛的金属材料是铝合金 |
| D、青铜、碳素钢、合金钢和硬铝都是合金 |
 如图是铅蓄电池充、放电时的工作示意图,已知放电时电池反应为( )
如图是铅蓄电池充、放电时的工作示意图,已知放电时电池反应为( )2PbSO4+2H2O
| 充电 |
| 放电 |
2- 4 |
| A、K与N相接时,能量由电能转化为化学能 |
| B、K与N相接时,H+向负极区迁移 |
| C、K与M连接时,所用电源的a极为负极 |
| D、K与M相接时,阳极附近的pH逐渐增大 |
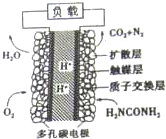 尿液也能发电,尿素燃料电池结构如图所示,用这种电池既能净化含氨废水,又能发电.下列关于该电池描述不正确的是( )
尿液也能发电,尿素燃料电池结构如图所示,用这种电池既能净化含氨废水,又能发电.下列关于该电池描述不正确的是( )| A、电流从左侧电极经过负载后流向右侧电极 |
| B、电池放电时,H+从正极向负极迁移 |
| C、电池的负极反应式:CO(NH2)2+H2O-6e-=N2+CO2+6H+ |
| D、电池降解1mol尿素,理论上消耗标准状况下33.6LO2 |
 W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )| A、X、Y、Z中最简单氢化物稳定性最弱的是X |
| B、氧化物对应水化物的酸性Z一定强于Y |
| C、形成的单核阴离子还原性Y强于X |
| D、Z元素单质在化学反应中只表现氧化性,它在水溶液中有漂白性 |
某可逆反应过程的能量变化如图所示,下列说法正确的是( )


| A、该反应能量变化类型与CaCO3分解反应相同 |
| B、加催化剂后,正反应速率加快,逆反应速率减少 |
| C、反应热△H=E2-E1 |
| D、若该反应为氧化还原反应,则可以将其设计成原电池 |
关于键长、键能和键角,下列说法不正确的是( )
| A、键角是确定多分子立体结构(分子形状)的重要参数 |
| B、通过反应物和生成物分子中键能数据可以粗略预测反应热的大小 |
| C、键长越长,键能必越小,共价化合物必越稳定 |
| D、同种原子间形成的共价键键长长短总是遵循;叁键<双键<单键 |