题目内容
19.25℃,将a mol•L-1氨水与b mol•L-1盐酸等体积混合后溶液呈中性,则此时溶液中c(NH4+)=c(Cl-)(填“>”、“<”或“﹦”);用含a、b的代数式表示该温度下NH3•H2O的电离平衡常数Kb=$\frac{b×1{0}^{-7}}{a-b}$.分析 根据电荷守恒判断;溶液中存在平衡NH3.H2O?NH4++OH-,根据溶液的pH值计算溶液中c(OH-),根据氯离子浓度计算c(NH4+),利用物料守恒计算溶液中c(NH3.H2O),代入NH3•H2O的电离常数表达式计算;
解答 解:根据电荷守恒有c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于溶液呈中性,则c(H+)=c(OH-),故c(NH4+)=c(Cl-),故c(H+)=c(OH-),
溶液呈中性,溶液中c(OH-)=10-7mol/L,溶液中c(NH4+)=c(Cl-)=$\frac{1}{2}$×bmol•L-1=0.5bmol•L-1,故混合后溶液中c(NH3.H2O)=$\frac{1}{2}$×amol•L-1-0.5bmol•L-1=(0.5a-0.5b)mol/L,NH3•H2O的电离常数Kb=$\frac{1{0}^{-7}×0.5b}{(0.5a-0.5b)}$=$\frac{b×1{0}^{-7}}{a-b}$,
故答案为:=;$\frac{b×1{0}^{-7}}{a-b}$.
点评 本题考查弱电解质电离,根据电荷守恒确定溶液离子浓度的关系,结合一水合氨电离平衡常数解答问题,注意二者混合后溶液体积增大一倍,物质浓度降为原来一半,为易错点.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
10.X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构.下列说法正确的是( )
| A. | 原子半径:Z>Y>X | |
| B. | X、Y、Z三种元素的单质中,Z单质的氧化性最强 | |
| C. | CaY2与水发生氧化还原反应时,CaY2只作氧化剂 | |
| D. | CaX2、CaY2、CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2 |
14.两份质量相同的CH4和NH3比较,下列结论错误的是( )
| A. | 分子个数比为17:16 | |
| B. | 同温同压下两种气体的体积之比是17:16 | |
| C. | 氢原子个数比为17:12 | |
| D. | 原子个数比为17:16 |
4.一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+.下列有关说法正确的是( )
| A. | 电池反应的化学方程式为:CH3CH2OH+O2═CH3COOH+H2O | |
| B. | 检测时,电解质溶液中的 H+向负极移动 | |
| C. | 若有 0.4 mol 电子转移,则在标准状况下消耗 4.48 L 氧气 | |
| D. | 正极上发生的反应为:O2+4e-+2H2O═4OH- |
8.化合物X的分子式为C5H11Cl,用NaOH的醇溶液处理X,可得分子式为C5H10的两种产物Y、Z,Y、Z经催化加氢后都可得到2-甲基丁烷.若将化合物X用NaOH的水溶液处理,则所得有机产物的结构简式可能是( )
| A. | CH3CH2CH2CH2CH2OH | B. | 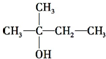 | ||
| C. | 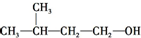 | D. | 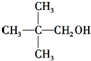 |
9.下列各组有机化合物中,肯定属于同系物的一组是( )
| A. | C3H6与C5H10 | B. | C3H8与C5H12 | C. | C2H6O与C5H8O | D. | C7H8与C6H6 |
 向100mL 3mol/L NaOH溶液中缓慢通入一定量的CO2,充分反应后,测得溶液的pH>7.
向100mL 3mol/L NaOH溶液中缓慢通入一定量的CO2,充分反应后,测得溶液的pH>7. .
.