题目内容
3.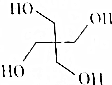 季戊四醇被大量用于涂料工业生产醇酸树脂、合成高级润滑剂、增塑剂、表面活性剂以及医药、炸药等,其结构简式如图所示.季戊四醇可由HCHO与CH3CHO两种有机物按一定比例加成得到的产物与H2再加成得到.则反应中HCHO与CH3CHO的物质的量之比为( )
季戊四醇被大量用于涂料工业生产醇酸树脂、合成高级润滑剂、增塑剂、表面活性剂以及医药、炸药等,其结构简式如图所示.季戊四醇可由HCHO与CH3CHO两种有机物按一定比例加成得到的产物与H2再加成得到.则反应中HCHO与CH3CHO的物质的量之比为( )| A. | 1:1 | B. | 1:2 | C. | 3:1 | D. | 3:2 |
分析 季戊四醇可由HCHO与CH3CHO两种有机物按一定比例加成得到的产物与H2再加成得到,根据C、O原子守恒计算HCHO与CH3CHO的物质的量之比.
解答 解:季戊四醇可由HCHO与CH3CHO两种有机物按一定比例加成得到的产物与H2再加成得到,
设生成1mol季戊四醇需要HCHO、CH3CHO的物质的量分别为xmol、ymol,
根据碳原子守恒:x+2y=5
根据O原子守恒:x+y=4
联立解得x=3、y=1
故HCHO与CH3CHO的物质的量之比为3:1,
故选:C.
点评 本题考查有机物合成、加成反应,注意利用原子守恒进行分析解答,侧重考查学生分析计算能力.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
13.下列关于胶体,判断正确的是( )
| A. | 煮沸饱和FeCl3溶液可以制得Fe(OH)3胶体 | |
| B. | 胶体的本质特征是胶粒半径在1~100nm | |
| C. | 丁达尔现象可以用来区别胶体和溶液 | |
| D. | 溶液能通过滤纸孔隙而胶体的分散质不能通过 |
14.在一定温度下,可逆反应A2(g)+B2(g)═2AB(g)达到化学平衡的标志是 ( )
| A. | 容器内气体的总质量不随时间而变化 | |
| B. | 单位时间内有nmolA2生成的同时就有nmolB2生成 | |
| C. | 2 v(A2)正=v(AB)逆 | |
| D. | A2、B2(g)、AB(g)的浓度之比为1:1:2 |
11.已知某元素的阳离子R2+的核内中子数为n,质量数为A,则mg它的氧化物中所含电子的物质的量是( )
| A. | $\frac{m}{A+16}$(A-n+8)mol | B. | $\frac{m}{A+16}$(A-n+10)mol | C. | (A-n+2)mol | D. | $\frac{m}{A}$(A-n+6)mol |
3.如图所示是气体性质实验的常用装置,下列有关实验现象的说法不正确的是( )
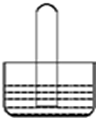

| A. | 若水槽中是水,试管中是NO2,可看到液面上升并且气体颜色逐渐变浅 | |
| B. | 若水槽中是NaOH溶液,试管中是Cl2,可看到液面上升、试管中黄绿色褪去 | |
| C. | 若水槽中是水并滴有几滴紫色石蕊,试管中是SO2,可看到液面上升并变为无色 | |
| D. | 若水槽中是水并滴有几滴酚酞,试管中是NH3,可看到液面上升并呈红色 |
4.下列有关功能高分子材料的用途的叙述中不正确的是( )
| A. | 高吸水性树脂可用于干旱地区抗旱保水、改良土壤、改造沙漠 | |
| B. | 离子交换树脂主要用于分离和提纯物质 | |
| C. | 医用高分子可用于制造医用器械和人造器官 | |
| D. | 聚乙炔膜可用于分离工业废水和海水的淡化 |
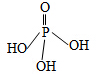 (1)三聚磷酸可视为三个磷酸分子(磷酸的结构如图)之间脱去两个分子的产物,其结构式为
(1)三聚磷酸可视为三个磷酸分子(磷酸的结构如图)之间脱去两个分子的产物,其结构式为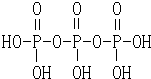 .三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.
.三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10. X、Y、Z、M、N、Q P为元素周期表前四周期的7种元素.其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.P元素的第三电子层处于全充满状态,第四电子层只有一个电子请回答下列问题:
X、Y、Z、M、N、Q P为元素周期表前四周期的7种元素.其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.P元素的第三电子层处于全充满状态,第四电子层只有一个电子请回答下列问题: ,P元素属于ds区元素.
,P元素属于ds区元素.