题目内容
将相等物质的量的CO和H2O(g)混合,在一定条件下反应:CO(g)+H2O(g)?CO2(g)+H2(g),达到平衡后CO的转化率为25%,平衡混合气体的密度是相同条件下氢气的倍数是( )
| A、46 | B、23 |
| C、11.5 | D、5.75 |
考点:化学平衡的计算
专题:化学平衡专题
分析:由于在反应CO(g)+H2O(g)?CO2(g)+H2(g)中,反应前后总物质的量不变,气体的质量也守恒,所混合气体的平均相对分子质量为
=23,利用密度之比等于相对分子质量之比可以解题;
| 1mol×28g/mol+1mol×18g/mol |
| 2mol |
解答:
解:由于在反应CO(g)+H2O(g)?CO2(g)+H2(g)中,反应前后总物质的量不变,气体的质量也守恒,所混合气体的平均相对分子质量为
=23,利用密度之比等于相对分子质量之比可以得到混合气体的密度与相同条件下H2密度的比为23:2=11.5;
故选C;
| 1mol×28g/mol+1mol×18g/mol |
| 2mol |
故选C;
点评:本题主要考查相对密度的计算,在解题时要注意运用元素守恒和物质的量守恒思想,难度不大.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
下列叙述中不正确的是( )
| A、过氧化钠与水反应后的溶液滴加酚酞,液体会变为红色 |
| B、过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源 |
| C、碳酸钠俗称大苏打,碳酸氢钠俗称苏打 |
| D、氧化铝是冶炼金属铝的重要原料,也是一种比较好的耐火材料,它可以用来制造耐火坩埚,耐火管和耐高温的实验仪器 |
下列实验装置(部分固定装置略去)和有关叙述不正确的是( )
A、 可以测量锌粒与硫酸的反应速率 |
B、 可以进行中和热的测定实验 |
C、 可验证温度对化学平衡的影响 |
D、 可研究催化剂对化学反应速率的影响 |
实验是化学研究的基础.下列关于各实验装置的叙述正确的是( )


| A、装置①常用于分离乙醇或苯等与水组成的混合物 |
| B、装置②可用于吸收NH3或HCl气体,并防止倒吸 |
| C、装置③可用于收集H2、CO2、Cl2、NO等气体 |
| D、装置④可用于干燥、收集氨气,并吸收多余的氨气 |
常温下,下列各组离子或分子在指定溶液中能大量共存的是( )
| A、氨水中:NH4+、Fe2+、SO42-、HSO3- |
| B、pH=l的溶液中:Mg2+、Fe3+、Cl-、NO3- |
| C、通入足量CO2的溶液中:Ca2+、Na+、CO32-、SiO32- |
| D、水电离产生的c(H+)=1×10-14 mol?L-1的溶液中:Al3+、K+、Cl、CH3COO- |

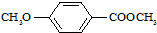
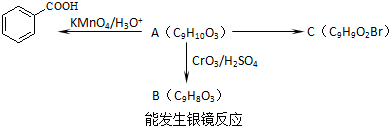
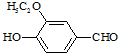 )是食品添加剂的增香原料,其香味比香草醛更加浓郁.
)是食品添加剂的增香原料,其香味比香草醛更加浓郁.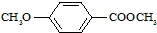 )是一种医药中间体,请设计合理方案用茴香醛(
)是一种医药中间体,请设计合理方案用茴香醛( 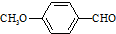 )合成X.用反应流程图表示如下:
)合成X.用反应流程图表示如下: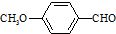 →
→