题目内容
 绿矾是一种重要的化工原料.
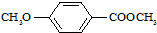
绿矾是一种重要的化工原料.【问题1】绿矾晶体(FeSO4?7H2O)由于保存不妥或长久放置,容易被空气中的氧气氧化而变质.为探究绿矾样品的变质情况,某化学兴趣小组的同学设计了下列实验方案.
实验准备:取少量绿矾样品,用蒸馏水在烧杯中配成溶液.
(1)方案1:取少量溶液,加入几滴
写出溶液变红的离子反应方程式
(2)方案2:取少量溶液,加入几滴酸性KMnO4溶液,如果观察到的现象是
(3)要从FeSO4溶液中得到绿矾晶体,必须进行的实验操作步骤:
A.蒸发皿 B.石棉网 C.烧杯 D.玻璃棒
【问题2】灼烧绿矾的反应方程式:2(FeSO4?7H2O)═Fe2O3+SO2↑+SO3↑+14H2O
工业上常通过高温分解FeSO4的方法制备Fe2O3,为检验FeSO4高温分解的气体产物中是否含有SO2和SO3,进行如下实验:将FeSO4高温分解产生的气体通入如图所示的装置中.请回答以下问题:
(1)装置I中氯化钡溶液中可观察到现象
(2)装置Ⅱ中试剂为品红溶液,其作用是
(3)装置Ⅲ中试剂为NaOH溶液,其作用是
考点:性质实验方案的设计
专题:实验设计题
分析:【问题1】(1)绿矾样品被氧化会生成Fe3+,Fe3+可使KSCN溶液会变血红色;
(2)Fe2+能使酸性KMnO4溶液褪色,如果观察不到酸性KMnO4溶液褪色,说明证明绿矾样品完全被氧化;
(3)由溶液得到晶体的步骤为:蒸发浓缩、冷却结晶、过滤、自然干燥,蒸发操作需要蒸发皿、玻璃棒,过滤需要烧杯;
【问题2】氯化钡溶液用于检验产物SO3,品红溶液用于检验产物SO2,氢氧化钠溶液用于尾气吸收,通过2.33克硫酸钡沉淀可计算出SO3的物质的量,再根据2FeSO4?7H2O═Fe2O3+SO2↑+SO3↑+14H2O可得SO2的物质的量,根据化合物变化计算转移电子数.
(2)Fe2+能使酸性KMnO4溶液褪色,如果观察不到酸性KMnO4溶液褪色,说明证明绿矾样品完全被氧化;
(3)由溶液得到晶体的步骤为:蒸发浓缩、冷却结晶、过滤、自然干燥,蒸发操作需要蒸发皿、玻璃棒,过滤需要烧杯;
【问题2】氯化钡溶液用于检验产物SO3,品红溶液用于检验产物SO2,氢氧化钠溶液用于尾气吸收,通过2.33克硫酸钡沉淀可计算出SO3的物质的量,再根据2FeSO4?7H2O═Fe2O3+SO2↑+SO3↑+14H2O可得SO2的物质的量,根据化合物变化计算转移电子数.
解答:
解:【问题1】
(1)绿矾样品被氧化会生成Fe3+,有Fe3+存在即可明绿矾样品已被氧化,Fe3+可使KSCN溶液会变血红色,离子方程式为 Fe3++3SCN-?Fe(SCN)3,
故答案为:KSCN溶液;Fe3++3SCN-?Fe(SCN)3;
(2)Fe2+能使酸性KMnO4溶液褪色,若溶液不褪色,说明溶液中没有Fe2+,则证明绿矾样品完全被氧化,
故答案为:溶液不褪色;
(3)由溶液得到晶体的步骤为:蒸发浓缩、冷却结晶、过滤、自然干燥,蒸发操作需要蒸发皿、玻璃棒,过滤需要烧杯,
故答案为:蒸发浓缩;ACD;
【问题2】(1)氯化钡溶液用于检验产物SO3,SO3+H2O=H2SO4,硫酸与氯化钡反应生成硫酸钡白色沉淀,装置Ⅰ中氯化钡溶液中可观察到有白色沉淀产生;
FeSO4高温分解产生的n(SO3)=n(BaSO4)=
=0.01mol,
由2FeSO4?7H2O═Fe2O3+SO2↑+SO3↑+14H2O可得n(SO2)=n(SO3)=0.01mol,
S的化合价由+6→+4,因此转移电子数为0.01mol×(6-4)=0.02mol,
故答案为:有白色沉淀产生;0.02;
(2)SO2具有漂白性,可以使品红溶液褪色,因此品红溶液用于检验产物SO2,
故答案为:检验产生的气体中是否含SO2;
(3)氢氧化钠溶液用于吸收多余的SO2,防止造成空气污染,
故答案为:除去多余的SO2,防止污染空气.
(1)绿矾样品被氧化会生成Fe3+,有Fe3+存在即可明绿矾样品已被氧化,Fe3+可使KSCN溶液会变血红色,离子方程式为 Fe3++3SCN-?Fe(SCN)3,
故答案为:KSCN溶液;Fe3++3SCN-?Fe(SCN)3;
(2)Fe2+能使酸性KMnO4溶液褪色,若溶液不褪色,说明溶液中没有Fe2+,则证明绿矾样品完全被氧化,
故答案为:溶液不褪色;
(3)由溶液得到晶体的步骤为:蒸发浓缩、冷却结晶、过滤、自然干燥,蒸发操作需要蒸发皿、玻璃棒,过滤需要烧杯,
故答案为:蒸发浓缩;ACD;
【问题2】(1)氯化钡溶液用于检验产物SO3,SO3+H2O=H2SO4,硫酸与氯化钡反应生成硫酸钡白色沉淀,装置Ⅰ中氯化钡溶液中可观察到有白色沉淀产生;
FeSO4高温分解产生的n(SO3)=n(BaSO4)=
| 2.33g |
| 233g/mol |
由2FeSO4?7H2O═Fe2O3+SO2↑+SO3↑+14H2O可得n(SO2)=n(SO3)=0.01mol,
S的化合价由+6→+4,因此转移电子数为0.01mol×(6-4)=0.02mol,
故答案为:有白色沉淀产生;0.02;
(2)SO2具有漂白性,可以使品红溶液褪色,因此品红溶液用于检验产物SO2,
故答案为:检验产生的气体中是否含SO2;
(3)氢氧化钠溶液用于吸收多余的SO2,防止造成空气污染,
故答案为:除去多余的SO2,防止污染空气.
点评:本题考查了重要离子和常见化合物的检验,综合性强,难度中等,所有的实验药品、实验步骤、实验现象、实验装置均取决于实验原理,因此掌握物质的性质及检测原理是解题的关键.

练习册系列答案
相关题目
用0.100mol?L-1的盐酸滴定10ml 0.100mol?L-1的Na2CO3溶液.溶液pH值与加入盐酸的体积的关系如图所示,已知室温时饱和CO2的pH为3.9,0.05mol?L-1 NaHCO3的pH约为8.3,下列说法不正确的是( )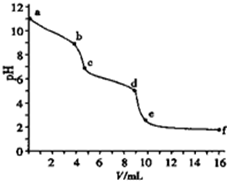

| A、以酚酞为指示剂,溶液颜色发生突变时(b点),Na2CO3转化为NaHCO3 |
| B、以甲基橙为指示剂,溶液颜色发生突变时,共消耗盐酸20.00ml |
| C、溶液pH=7(c点),碳酸钠完全转化为NaCl |
| D、ce段对应溶液中CO2与NaHCO3共存 |
从铝土矿制备铝所涉及的反应中,不属于离子反应的是( )
| A、铝土矿溶于NaOH溶液中 |
| B、NaAlO2溶液的酸化 |
| C、灼烧氢氧化铝固体 |
| D、电解熔融的氧化铝 |
下列实验装置(部分固定装置略去)和有关叙述不正确的是( )
A、 可以测量锌粒与硫酸的反应速率 |
B、 可以进行中和热的测定实验 |
C、 可验证温度对化学平衡的影响 |
D、 可研究催化剂对化学反应速率的影响 |
常温时,下列关于溶液的pH或微粒的物质的量浓度的说法不正确的是( )
| A、将等体积的盐酸和氨水混合,充分反应后所得溶液呈中性,则两溶液的物质的量浓度关系为:c(HCl)<c(NH3?H2O) |
| B、某溶液中只存在Cl-、OH、NH4+、H+四种离子,则一定不存在下列关系:c(Cl-)>c(NH4+)>c(H+)=c(OH-) |
| C、将0.2 mol?L-1的某一元酸HA溶液和0.1 mol?L-1NaOH溶液等体积混合后,溶液pH大于7,则反应后的混合液中:2c(OH-)+c(A-)=2c(H+)+c(HA) |
| D、某物质的溶液中由水电离出的c(H+)=1×10-amol?L-1,则溶液的pH一定为14-a |

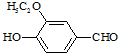 )是食品添加剂的增香原料,其香味比香草醛更加浓郁.
)是食品添加剂的增香原料,其香味比香草醛更加浓郁.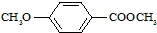 )是一种医药中间体,请设计合理方案用茴香醛(
)是一种医药中间体,请设计合理方案用茴香醛( 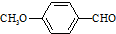 )合成X.用反应流程图表示如下:
)合成X.用反应流程图表示如下: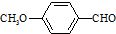 →
→