题目内容
10.下列化工生产过程中所发生的主要化学反应不属于氧化还原反应的是( )| A. | 用氯气和氢氧化钠溶液制消毒水 | B. | 用铝热法冶炼金属钒 | ||
| C. | 用油脂制肥皂 | D. | 海水提溴 |
分析 发生的反应中含元素的化合价变化,为氧化还原反应;不存在元素的化合价变化,为非氧化还原反应,以此来解答.
解答 解:A.反应生成氯化钠、次氯酸钠,Cl元素的化合价变化,为氧化还原反应,故A不选;
B.Al、钒元素的化合价变化,为氧化还原反应,故B不选;
C.油脂在碱性条件下水解反应可制备肥皂,无元素的化合价变化,为非氧化还原反应,故C选;
D.Br元素的化合价升高,为氧化还原反应,故D不选;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意反应中元素化合价判断,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.将11.2g铁粉和3.2g硫粉均匀混合,在密闭容器中加热到红热,冷却后加入足量的盐酸,在标准状况下收集到的气体体积为( )
| A. | 11.2L | B. | 5.6L | C. | 4.48L | D. | 2.24L |
5.在一密闭容器中混有CO2、CO、H2三种气体,其平均式量为26.25,投入足量的Na2O2(体积不计)不断用电火花引燃至反应停止,恢复到原温度时,容器内的压强为原来的25%,则混合气体中CO的体积分数为( )
| A. | 20% | B. | 12.5% | C. | 17.5% | D. | 25% |
15.键能为破坏1mol化学键所需要吸收的能量或形成1mol化学键所放出的能量.已知H-H的键能为436kJ/mol,H-Cl的键能为432kJ/mol,氢气与氯气反应时放出热量.据此判断,下列说法不正确的是( )
| A. | H2分子比H原子更稳定 | |
| B. | 可求出Cl-Cl 的键能为428 kJ/mol | |
| C. | 1mol氢气与1mol氯气所含的总能量比2mol HCl所含的总能量高 | |
| D. | 理论上利用此反应制取盐酸的同时,可依据原电池原理获取电能 |
19.下列电解质溶液的有关叙述正确的是( )
| A. | 同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 | |
| B. | 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 | |
| C. | 二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质 | |
| D. | 在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)═c(CH3COO-) |
20.为验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).
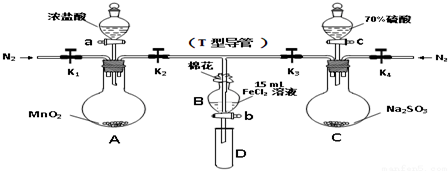
实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,加热A.
Ⅲ.当B中溶液变黄时,停止加热,夹紧K2.
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,并检验其中的离子.
Ⅴ.打开K3和活塞c,加入70%的硫酸,一段时间后夹紧K3.
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子..
(1)过程Ⅰ的目的是排出装置中的空气,防止干扰.
(2)若向第Ⅲ步B中的黄色溶液中通入H2S气体,会观察到有淡黄色沉淀生成,写出该反应的离子方程式2Fe3++H2S═2Fe2++2H++S↓
(3)若将制取的SO2通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的化学方程式为2KMnO4+5SO2+2H2O=2MnSO4+K2SO4+2H2SO4
(4)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是甲(填“甲”“乙”“丙”)
(5)将B中的FeCl2溶液换成100mLFeBr2溶液并向其中通入1.12LCl2(标准状况下),若溶液中有$\frac{1}{2}$的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为0.5mol/L.

实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,加热A.
Ⅲ.当B中溶液变黄时,停止加热,夹紧K2.
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,并检验其中的离子.
Ⅴ.打开K3和活塞c,加入70%的硫酸,一段时间后夹紧K3.
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子..
(1)过程Ⅰ的目的是排出装置中的空气,防止干扰.
(2)若向第Ⅲ步B中的黄色溶液中通入H2S气体,会观察到有淡黄色沉淀生成,写出该反应的离子方程式2Fe3++H2S═2Fe2++2H++S↓
(3)若将制取的SO2通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的化学方程式为2KMnO4+5SO2+2H2O=2MnSO4+K2SO4+2H2SO4
(4)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是甲(填“甲”“乙”“丙”)
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
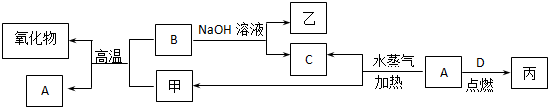
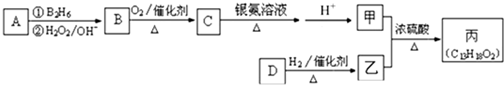
 -CH=CHCHO
-CH=CHCHO -CH2CH2CH2OH
-CH2CH2CH2OH (CH3)2CHCOOCH2CH2CH2-
(CH3)2CHCOOCH2CH2CH2- +H2O
+H2O