题目内容
18.A、B、C、D是四种常见的单质,A、B为金属;C、D常温下是气体,且D为黄绿色气体.甲、乙、丙为常见的化合物,甲物质具有磁性.它们之间有如图的转化关系: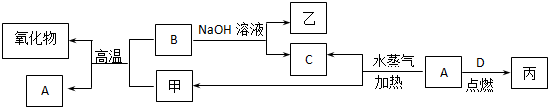
请回答下列问题:
(1)B与甲反应的化学方程式是8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3.B与NaOH溶液反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.甲与足量盐酸溶液反应的离子方程式是Fe3O4+8H+=Fe3++2Fe2++4H2O.
(2)含有B的阳离子的溶液与乙溶液反应得到一种白色沉淀,该反应的离子方程式是Al3++3AlO2-+6H2O=4Al(OH)3↓.
(3)实验室检验丙溶液中所含金属阳离子的操作方法和现象是取丙溶液少量,加入KSCN溶液,溶液呈血红色,则为Fe3+.
分析 A、B、C、D是四种常见的单质,A、B为金属,C、D常温下是气体,且D为黄绿色气体,D为Cl2,甲具有磁性的物质,则甲为Fe3O4,甲与B的反应为铝热反应,B为Al,A为Fe,乙为NaAlO2,C为H2,Fe与氯气反应生成丙,丙为FeCl3,然后结合元素化合物性质及离子检验来解答.
解答 解:A、B、C、D是四种常见的单质,A、B为金属,C、D常温下是气体,且D为黄绿色气体,D为Cl2,甲具有磁性的物质,则甲为Fe3O4,甲与B的反应为铝热反应,B为Al,A为Fe,乙为NaAlO2,C为H2,Fe与氯气反应生成丙,丙为FeCl3,
(1)B与甲反应的化学方程式是8A1+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4A12O3+9Fe,与氢氧化钠反应生成偏铝酸钠和氢气,反应的离子方程式为2A1+2OH-+2H2O═2A1O2+3H2↑,甲与足量盐酸溶液反应的离子方程式是:Fe3O4+8H+=Fe3++2 Fe2++4H2O,
故答案为:8A1+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4A12O3+9Fe;2A1+2OH-+2H2O═2A1O2+3H2↑;Fe3O4+8H+=Fe3++2 Fe2++4H2O;
(2)含有B形成的阳离子的溶液含有A13+,可与A1O2-发生互促水解反应生成氢氧化铝沉淀,反应的离子方程式为A13++3A1O2-+6H2O═4A1(OH)3↓,
故答案为:A13++3A1O2-+6H2O═4A1(OH)3↓;
(3)丙溶液中所含金属阳离子为Fe3+,可用KSCN溶液鉴别,滴加KSCN溶液,若溶液变红,说明丙中存在Fe3+,
故答案为:取少量丙的溶液于试管中,滴加KSCN溶液,若溶液变红,说明丙中存在Fe3+.
点评 本题综合考查无机物的推断、电解等知识,注意利用物质的性质及转化关系推断物质为解答的关键,侧重分析能力、推断能力及知识综合应用能力的考查,答题时注意把握物质的颜色以及磁性等信息,题目难度中等.

 口算能手系列答案
口算能手系列答案| A. | 通入足量的溴水 | B. | 通入足量的酸性高锰酸钾溶液 | ||
| C. | 在导管口点燃 | D. | 一定条件下与H2反应 |
| A. | 1.0mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 酚酞呈红色的溶液:NH4+、Ba2+、CO32-、Cl- | |
| C. | pH=12的溶液:K+、Na+、CH3COO-、Br- | |
| D. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
| A. | 用氯气和氢氧化钠溶液制消毒水 | B. | 用铝热法冶炼金属钒 | ||
| C. | 用油脂制肥皂 | D. | 海水提溴 |
| A. | 测量溶液的温度计要一直插在溶液中 | |
| B. | 应该向酸(碱)中慢慢滴加碱(酸) | |
| C. | 反应前需要用温度计测量酸(碱)温度 | |
| D. | 反应中酸或碱应适当过量 |
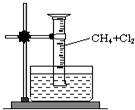 某研究小组为了探究甲烷和氯气反应的情况,设计了如下实验.请填写下列空白:
某研究小组为了探究甲烷和氯气反应的情况,设计了如下实验.请填写下列空白: