题目内容
20.将11.2g铁粉和3.2g硫粉均匀混合,在密闭容器中加热到红热,冷却后加入足量的盐酸,在标准状况下收集到的气体体积为( )| A. | 11.2L | B. | 5.6L | C. | 4.48L | D. | 2.24L |
分析 加热发生反应为Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,加入盐酸一定发生反应FeS+2HCl=FeCl2+H2S↑,而Fe与盐酸反应为Fe+2HCl=FeCl2+H2↑,由方程式可知加热过程中,无论铁过量与否,与盐酸反应最终得到的气体的物质的量等于原混合物中Fe的物质的量,再根据V=nVm计算生成气体的体积.
解答 解:发生反应为Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,加入盐酸一定发生反应FeS+2HCl=FeCl2+H2S↑,而Fe与盐酸反应为Fe+2HCl=FeCl2+H2↑,由方程式可知加热过程中,无论铁过量与否,与盐酸反应最终得到的气体的物质的量等于原混合物中Fe的物质的量,
所以生成气体的总物质的量为:n(气体)=n(Fe)=$\frac{11.2g}{56g/mol}$=0.2mol,标准状况下该气体体积为:0.2mol×22.4L/mol=4.48L,
故选C.
点评 本题考查化学方程式的计算,题目难度中等,明确发生反应实质为解答关键,注意利用方程式判断生成气体与原混合物中Fe的物质的量相等,可避免加热过程中的过量计算的繁琐,试题有利于提高学生的分析能力及化学计算能力.

练习册系列答案
相关题目
19.下列对实验现象的解释与结论正确的是( )
| A. | 向铜和稀硫酸的混合物中加入无色溶液,溶液逐渐变成蓝色,铜逐渐溶解,则该无色溶液一定是硝酸 | |
| B. | 用蘸有浓氨水的玻璃棒置于某无机酸浓溶液的试剂瓶口,有大量白烟,说明该无机酸一定为盐酸 | |
| C. | SO2气体通入Ba(NO3)2溶液中,溶液出现浑浊现象,说明有BaSO3沉淀生成 | |
| D. | 向NaHCO3溶液中滴加酚酞试液,加热时溶液由淡红色变为红色,冷却后溶液由红色变为淡红色,说明HCO3-在水溶液中存在水解平衡 |
20.下列实验操作正确的是( )
| A. | 制取蒸馏水时,为了防止瓶内产生暴沸现象,应先向烧瓶内加入几片碎瓷片 | |
| B. | 稀释浓硫酸时,常把水加入到盛浓硫酸的烧杯中 | |
| C. | 做CO还原Fe2O3实验时,为防止CO污染环境,实验完毕,常先停止通CO,再停止加热 | |
| D. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 |
15.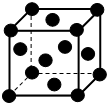 经探明我国在沿海大陆架和西藏地区蕴含丰富的可燃冰即甲烷水合物,如图是一种甲烷晶体的结构,图中每个小球代表一个甲烷分子(甲烷分子分别位于立方体的顶点和面心),下列有关该晶体说法正确的是( )
经探明我国在沿海大陆架和西藏地区蕴含丰富的可燃冰即甲烷水合物,如图是一种甲烷晶体的结构,图中每个小球代表一个甲烷分子(甲烷分子分别位于立方体的顶点和面心),下列有关该晶体说法正确的是( )
 经探明我国在沿海大陆架和西藏地区蕴含丰富的可燃冰即甲烷水合物,如图是一种甲烷晶体的结构,图中每个小球代表一个甲烷分子(甲烷分子分别位于立方体的顶点和面心),下列有关该晶体说法正确的是( )
经探明我国在沿海大陆架和西藏地区蕴含丰富的可燃冰即甲烷水合物,如图是一种甲烷晶体的结构,图中每个小球代表一个甲烷分子(甲烷分子分别位于立方体的顶点和面心),下列有关该晶体说法正确的是( )| A. | 该晶体与氯化钠的晶体类型相同 | |
| B. | 该晶体熔化只需要破坏共价键 | |
| C. | SiH4分子的稳定性强于甲烷 | |
| D. | 每个顶点的甲烷与之距离最近的甲烷分子有12个 |
5.下列关于“化学与健康”的说法不正确的是( )
| A. | 服用铬含量超标的药用胶囊会对人体健康造成危害 | |
| B. | “血液透析”利用了胶体的性质 | |
| C. | 明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 | |
| D. | 新型复合材料使手机、电脑等电子产品更轻巧、实用和新潮 |
12.下列关于化学键的叙述,正确的一项是( )
| A. | 离子化合物中一定含有离子键 | |
| B. | 单质分子中均不存在化学键 | |
| C. | 全部由非金属元素形成的化合物中不可能含有离子键 | |
| D. | 含有共价键的化合物一定是共价化合物 |
10.下列化工生产过程中所发生的主要化学反应不属于氧化还原反应的是( )
| A. | 用氯气和氢氧化钠溶液制消毒水 | B. | 用铝热法冶炼金属钒 | ||
| C. | 用油脂制肥皂 | D. | 海水提溴 |