题目内容
15.A、B、C、D是四种短周期元素,已知A、C同主族,B、D同周期,A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强,若B的阳离子比C的阴离子少一个电子层,(用A、B、C、D作答即可)A.原子序数:A<D<B<C;
B.原子半径:D>B>C>A;
C.离子半径:C>A>D>B.
分析 (1)A、B、C、D是四种短周期元素,A、C同主族,B、D同周期,A的气态氢化物比C的气态氢化物稳定,则A的原子序数小于C且A位于第二周期;B的阳离子比D的阳离子氧化性强,则金属性D>B,原子序数B>D,若B的阳离子比C的阴离子少一个电子层,则B、C、D位于第三周期,C是非金属元素,则原子序数C>D;
(2)原子电子层数越多,原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
(3)离子电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小.
解答 解:(1)A、B、C、D是四种短周期元素,A、C同主族,B、D同周期,A的气态氢化物比C的气态氢化物稳定,则A的原子序数小于C且A位于第二周期;B的阳离子比D的阳离子氧化性强,则金属性D>B,原子序数B>D,若B的阳离子比C的阴离子少一个电子层,则B、C、D位于第三周期,C是非金属元素,则原子序数C>D,则原子序数:A<D<B<C,
故答案为:A<D<B<C;
(2)原子电子层数越多,原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,则原子半径D>B>C>A,故答案为:D>B>C>A;
(3)离子电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,则离子半径:C>A>D>B,故答案为:C>A>D>B.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查学生分析判断能力,明确原子结构、元素周期表结构、元素周期律是解本题关键,注意原子半径及离子半径大小比较方法,题目难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
3.若R是元素周期表中第六周期、第ⅦA族元素,下列有关R的叙述,正确的是( )
| A. | R的单质在通常情况下呈气态 | B. | R的单质可能是一种无色的固体 | ||
| C. | R的氢化物稳定 | D. | 单质R与H2的化合反应非常困难 |
10.硅及其化合物在材料领域中应用广泛,下列叙述中不正确的是( )
| A. | 硅单质可用来制造太阳能电池 | |
| B. | 装碱性溶液的玻璃试剂瓶不能用玻璃塞 | |
| C. | 二氧化硅是制造光导纤维的材料 | |
| D. | 自然界硅元素的贮量丰富,并存在大量的单质硅 |
20.某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)( )
| A. | 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClO-=HClO+CH3COO- | |
| C. | 该消毒液与洁厕灵(成分为HCl)混用,产生Cl2:2H++Cl-+ClO-=Cl2↑+H2O | |
| D. | 该消毒液的pH约为12:ClO-+H2O?HClO+OH- |
4.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | NA个氧气分子与NA个氖气分子的质量比是4:5 | |
| B. | 17gOH-与19gH3O+所含电子数相等 | |
| C. | 32gSO2和40gSO3所含的原子数相等 | |
| D. | 标准状况下,11.2LCO2与常温常压下17gNH3所含分子数相等 |
5.某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如表:
(1)请写出铝热反应的化学反应方程式:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
(2)该同学推测铝热反应所得到的熔融物应是铁铝合金,理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理?答:合理(填“合理”或“不合理”).请写出铝热反应的一种工业用途焊接钢轨、冶炼难熔金属、定向爆破.
(3)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是NaOH溶液,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)实验室要溶解该熔融物,下列试剂中可以选用BC(填序号).
A.浓硫酸 B.稀硫酸C.稀硝酸 D.氢氧化钠溶液.
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
(2)该同学推测铝热反应所得到的熔融物应是铁铝合金,理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理?答:合理(填“合理”或“不合理”).请写出铝热反应的一种工业用途焊接钢轨、冶炼难熔金属、定向爆破.
(3)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是NaOH溶液,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)实验室要溶解该熔融物,下列试剂中可以选用BC(填序号).
A.浓硫酸 B.稀硫酸C.稀硝酸 D.氢氧化钠溶液.
 .MX与水反应可放出气体,该反应的化学方程式为NaH+H2O=NaOH+H2↑.
.MX与水反应可放出气体,该反应的化学方程式为NaH+H2O=NaOH+H2↑. ⑥
⑥ ⑦
⑦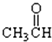 ⑧
⑧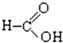 ⑨
⑨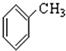 ⑩
⑩