题目内容
用NA表示阿伏加德罗常数,以下说法错误的是( )
| A、25℃,1.01×105Pa时,4g氦气所含的原子个数为NA |
| B、0.1 mol的OH-中所含电子个数为NA |
| C、120 g由NaHSO4和KHSO3组成的混合物中含有的硫原子数为NA |
| D、8.4 g的NaHCO3中含有的阳离子个数为0.2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、依据n=
计算物质的量,结合氦气分子是单原子分子分析;
B、依据氢氧根离子含10电子进行计算;
C、NaHSO4和KHSO3的摩尔质量相同为120g/mol,依据n=
计算物质的量得到硫原子数;
D、依据n=
计算物质的量,结合碳酸氢钠含有钠离子和碳酸氢根离子分析计算;
| m |
| M |
B、依据氢氧根离子含10电子进行计算;
C、NaHSO4和KHSO3的摩尔质量相同为120g/mol,依据n=
| m |
| M |
D、依据n=
| m |
| M |
解答:
解:A、依据n=
计算物质的量=
=1mol,氦气分子是单原子分子,4g氦气所含的原子个数为NA,故A正确;
B、氢氧根离子含有10电子,0.1 mol的OH-中所含电子个数为NA,故B正确;
C、NaHSO4和KHSO3的摩尔质量相同为120g/mol,依据n=
计算物质的量=
=1mol,得到硫原子数为NA,故C正确;
D、依据n=
计算物质的量=
=0.1mol,结合碳酸氢钠含有钠离子和碳酸氢根离子分析,含有的阳离子个数为0.1NA,故D错误;
故选D.
| m |
| M |
| 4g |
| 4g/mol |
B、氢氧根离子含有10电子,0.1 mol的OH-中所含电子个数为NA,故B正确;
C、NaHSO4和KHSO3的摩尔质量相同为120g/mol,依据n=
| m |
| M |
| 120g |
| 120g/mol |
D、依据n=
| m |
| M |
| 8.4g |
| 84g/mol |
故选D.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是各物理量的计算应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
下列实验现象中,由于发生取代反应而引起的是( )
| A、将灼热的铜丝迅速插入乙醇中,反复多次,有刺激性气味产生 |
| B、乙烯通入溴的四氯化碳溶液中,溶液褪色 |
| C、苯滴加到溴水中,振荡后水层接近无色 |
| D、甲烷和氯气的混合气体在光照后,瓶壁上有油状液滴附着 |
已知M、W、X、Y、Z为短周期元素,M为形成化合物最多的元素,W、Z同主族,X、Y、Z同周期,Z元素的原子序数为W的2倍,Z的最外层电子数为Y的最外层电子数的2倍,W和X能形成X2W和X2W2两种化合物,下列说法不正确的是( )
| A、W、X、Y形成的简单离子,其半径大小关系为Y>W>X |
| B、M、W元素形成的简单氢化物的稳定性:W>M |
| C、X金属元素是同周期中金属性最强的元素 |
| D、Z的最高价氧化物对应的水化物的浓溶液能与Y在常温下剧烈反应 |
设NA为阿伏加德罗常数的值,下列说法正确的组合是( )
a 12g 金刚石中含有的碳碳键的数目为2NA
b 1mol 明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA
c 标准状况下,2.24L乙烯和丙烯等物质的量混合气体中含有的共用电子对的数目为0.75NA
d 常温下,1mol?L-1的NH4NO3溶液中含有氮原子的数目为2NA
e 标准状况下,2.24L C6H14含原子总数大于2NA
f 17g H2O2中含有的电子数为9NA
g 将2mol SO2与1mol O2混合,发生反应转移的电子总数一定是4NA
h 常温下,100mL 1mol?L-1 AlCl3溶液中阳离子总数大于0.1NA.
a 12g 金刚石中含有的碳碳键的数目为2NA
b 1mol 明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA
c 标准状况下,2.24L乙烯和丙烯等物质的量混合气体中含有的共用电子对的数目为0.75NA
d 常温下,1mol?L-1的NH4NO3溶液中含有氮原子的数目为2NA
e 标准状况下,2.24L C6H14含原子总数大于2NA
f 17g H2O2中含有的电子数为9NA
g 将2mol SO2与1mol O2混合,发生反应转移的电子总数一定是4NA
h 常温下,100mL 1mol?L-1 AlCl3溶液中阳离子总数大于0.1NA.
| A、a c f h |
| B、a c e g |
| C、a c e f h |
| D、b d e h |
下列叙述正确的是( )
A、S2-的结构示意图是 |
B、HCl的电子式为 |
C、NH3的结构式为 |
| D、还原性:HCl>H2S |
设NA为阿伏加德罗常数的数值,下列说法正确的是(相对原子质量:N-14 O-16)( )
| A、23g NO2和N2O4的混合气体中含有的氮原子数为0.5NA |
| B、标准状况下,2.24L乙醇中含有的C-H数目为0.5NA |
| C、1mol?L-1的NaClO溶液中所含ClO-的数目为NA |
| D、室温下H2O2分解得到16g O2,转移的电子数为2NA |
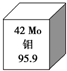 我国安徽发现了全国最大的钼矿,如图是钼元素的相关信息,下列有关钼的说法错误的是( )
我国安徽发现了全国最大的钼矿,如图是钼元素的相关信息,下列有关钼的说法错误的是( )| A、95Mo原子核内有53个中子 |
| B、95Mo原子核外有42个电子 |
| C、92Mo、95Mo、98Mo互为同位素 |
| D、92Mo、95Mo、98Mo的化学性质有较大的不同 |
下列实验过程和过程中涉及的离子反应方程式肯定正确的是( )
| A、除去硫酸铜溶液中的硫酸亚铁以最终制备胆矾晶体:2Fe2++Cl2=2Fe3++2Cl- |
| B、在含有Mn2+的溶液中加入HNO3酸化,再加入PbO2,反应体系显紫红色,5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O |
| C、向Ba(OH)2溶液中加入过量的NH4HSO4溶液:Ba2++2OH-+NH4++H++SO42-=BaSO4+NH3?H2O+H2O |
| D、氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O |
 Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.
Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.